定量蛋白质组学
上一篇 / 下一篇 2008-07-29 15:14:24/ 个人分类:蛋白质组
转载
建立在传统的双向凝胶电泳和染色基础上的定量方法,通过比较不同胶上蛋白质点的染色强度来进行相对定量。现有的染色方法包括银染、考马斯亮蓝染色,还有最新的荧光燃料。染色在显示蛋白质的存在的同时,还提供了其表达水平的信息。
传统的双向凝胶电泳(Two-dimensional electrophoresis,2-DE)技术由O’Farrell和Klose等人于1975年建立。第一向为等电聚焦(Isoelectrofocusing,IEF),使蛋白质根据等电点不同进行分离,第二向为SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),即将等电聚焦后的胶条放在SDS-PAGE上再根据蛋白质分子量不同进行电泳分离。由于具有高分辨率的特点,双向凝胶电泳在蛋白质组学的研究当中始终占据着重要的地位。
蛋白质组学研究的核心内容是蛋白质的动态变化和动态行为,即蛋白质的动态表达、动态定位、动态修饰和动态相互作用等,最终的研究目的是以大规模的尺度研究细胞内蛋白质的功能,这种研究要走向成熟必然要脱离对蛋白质的简单鉴定,实现对蛋白质的表达水平及其存在形式变化的检测。因此,定量技术应该说是整个蛋白质组学的精华部分。而这种定量通常不必是检测蛋白质在细胞内的绝对含量,而只需对其相对含量进行定量即可。
建立在传统的双向凝胶电泳和染色基础上的定量方法,通过比较不同胶上蛋白质点的染色强度来进行相对定量。现有的染色方法包括银染、考马斯亮蓝染色,还有最新的荧光燃料。染色在显示蛋白质的存在的同时,还提供了其表达水平的信息。
传统的双向凝胶电泳(Two-dimensional electrophoresis,2-DE)技术由O’Farrell和Klose等人于1975年建立。第一向为等电聚焦(Isoelectrofocusing,IEF),使蛋白质根据等电点不同进行分离,第二向为SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),即将等电聚焦后的胶条放在SDS-PAGE上再根据蛋白质分子量不同进行电泳分离。由于具有高分辨率的特点,双向凝胶电泳在蛋白质组学的研究当中始终占据着重要的地位。
现在的双向凝胶电泳技术第一向利用固相pH梯度(Immobilized pH
Gradient,IPG)等电聚焦技术,具有上样量大、分辨率高、重复性好等优点,并且可以提供蛋白质的等电点(pI)和分子量(MW)数值信息,有助于蛋白质的鉴定,而且双向凝胶电泳胶上常见的isoform多是蛋白质翻译后修饰的结果,对于这些蛋白质点的分析有助于了解对蛋白质功能影响重大的翻译后修饰。但是双向凝胶电泳技术本身也存在一些难以克服的缺陷,主要表现在两个方面。第一,双向凝胶电泳对蛋白质的分离受到蛋白质丰度、等电点、分子量和疏水性等的限制。对于低丰度蛋白质,由于上样量的限制不能达到足够质谱鉴定需要的量;对于极大蛋白质(相对分子质量>200
kDa)、极小蛋白质(相对分子质量<8
kDa)、极碱性蛋白质和疏水性蛋白质(膜结合蛋白质和跨膜蛋白质),都难以进行有效分离分析。第二,双向凝胶电泳操作费时费力,难以实现和质谱的直接联用,不易自动化。
目前在传统双向电泳技术的基础上发展出的双向荧光差异凝胶电泳(Two-dimensional fluorescence difference
gel electrophoresis, 2D-DIGE)
(图1),采用专有的荧光染料与多重样本和图象分析的方法,在同一块胶上可同时分离多个由不同荧光标记的样品,并以荧光标记的样品混合物为内标,对每个蛋白质点和每个差异都可以进行统计学可信度分析,从而具有良好的重复性和较高的准确率。另外,由于荧光染料的使用,使得双向荧光差异凝胶电泳具有高灵敏度的特性,能够满足高通量定量蛋白质组学研究分析的要求。
双向凝胶电泳作为蛋白质组学最经典的技术手段,随着本身的的不断发展,染色技术的突破,样品制备方案的改进,还将在蛋白质组学研究中继续发挥作用。
2. 基于质谱的蛋白质组学定量技术
基于质谱的蛋白质组学定量技术的基础在于肽段丰度可以用质谱峰的信号强度来表现,它可以分为两大类:第一类为标记定量技术(Labeling
quantitation),第二类则为非标记定量技术(Label-free quantitation),而前者则可更细分为体内标记(in vivo
labeling)定量技术和体外标记(in vitro labeling)定量技术。
标记定量技术的策略就是对来自不同样品的多肽掺入一个内部标准(Internal
Standards),便于质谱识别不同样品来源的肽段,同时标记与否的同一肽段的化学性质基本相同,这样就可以确保同一次质谱扫描中两者的离子化效率是相同的,质谱峰信号成对出现,而质谱峰的信号强度就可以作为定量的依据。这个内标必须满足一定的条件,例如不同样品来源的肽段标记后化学性质是相同的;如果和高效液相色谱联用,标记后的肽段的保留时间尽可能相同等等。根据内标掺入手段的不同,标记定量技术又可以分为体内标记(in
vivo labeling)定量技术和体外标记(in vitro labeling)定量技术。
体内标记是指细胞或者个体在含有稳定同位素的介质中生长,稳定同位素被掺入合成的蛋白质,从而充当了蛋白质定量的内部标准。常见的体内标记方法有15N体内代谢标记和细胞培养中稳定同位素标记氨基酸(Stable
Isotope Labeling By Amino Acids In Cell Culture,SILAC)的方法。
15N体内代谢标记是用富含15N的介质来培养酵母、细菌和哺乳类等细胞,15N被掺入合成的蛋白质中,从而充当其定量的内部标准。蛋白质每掺入一个15N,所在的肽段将比正常14N的相同肽大一个质量单位,使得不同细胞状态来源的肽段得到区分,肽质谱峰信号成对出现,从而根据质谱峰的信号强度进行准确的定量。但是这种体内标记策略有一个明显的缺点,就是由于相同肽段的不同同位素标记形式之间的质量变化依赖于氮原子数目,因此对未知的蛋白质难以进行定量。
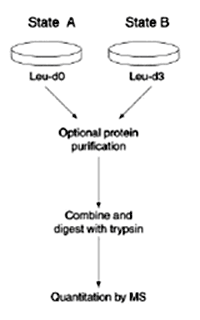
细胞培养中稳定同位素标记氨基酸的方法(SILAC)是2002年由Ong等人发明的一种体内标记定量技术,现已发展的比较成熟,应用广泛,主要操作流程如图2所示。这种方法就是在培养介质中加入稳定同位素标记的必需氨基酸,主要用于高等动物细胞中蛋白质的鉴定及定量。因为高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸(Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,而它本身无法合成这些必需氨基酸,需要从外界摄入补充。因此,在培养细胞时可以在培养介质中特异的加入用稳定同位素标记的某一种或者几种必需氨基酸,在经过适当的培养时间,细胞中的蛋白质被标记完全后,收获稳定同位素标记的细胞样品。与正常介质中培养收获的的细胞样品混合酶解,质谱鉴定时就可以从质谱图上得到成对出现的肽段信号峰,再通过相应的软件如RelEx和MSQuant等就可以得到蛋白质相对定量信息。相比较而言,用Lys来标记明显好于其他的必需氨基酸,因为当用胰蛋白酶(Trypsin)酶切时,保证了含有Lys残基的每个肽段都只含有一个标记物,从而避免了未知肽段其他标记所带来的质量变化不清的类似问题,而且有利于蛋白质做MS/MS鉴定时质谱图的解析。
由于体内标记技术不能实现对不可培养的样本的定量分析,Ishihama等发明了一种拓展的SILAC技术,称为culture-derived
isotope tags(CDITs),如图2所示。该技术以稳定同位素标记的细胞样品为内标,实现了对实际疾病状态下组织样品的定量。
总的来说,体内标记相对于体外标记方法具有一些自身的优势,它省去了标记化学反应和分离纯化等步骤,因而减少了样品的损失。同时,体内标记也存在一些缺点。首先,它不能对组织来源的蛋白质进行分析;其次,培养细胞在富含稳定同位素的介质中生长,这些介质可能会影响细胞的繁殖和其他生物进程,由此改变蛋白质的表达水平;第三,这种方法受到同位素材料成本的限制,不可能对整个动物个体进行标记;最后,对于未知序列肽段,大多数的体内标记都无法确定标记物与肽段之间量的关系,从而使得我们难以确认同一肽段在质谱图上成对出现的不同同位素标记形式。
图3. culture-derived isotope tags(CDITs)
体外标记定量是指在体外采用化学反应将合成好的内标与蛋白质结合,这种方法由于增加了化学反应的步骤,会面临样品损失和标记不完全的问题,但是由于它使样品来源不再局限于培养的细胞或者个体,可以实现对实际疾病状态下的组织或体液样品进行定量分析,从而具有良好的发展前景。
根据标记的蛋白质部位不同,体外标记分为以下几种类型:N末端肽段标记,如iTRAQ;C末端肽段标记,如16O/18O标记策略;和一些特殊氨基酸标记,如半胱氨酸(cysteine)标记ICAT策略等。这里主要介绍一下实验室常用的ICAT技术和新出现的iTRAQ技术。
同位素标记的亲和标签(isotope-coded affinity
tag,ICAT)技术作为一种体外标记稳定同位素的相对定量方法,已经成为重要的蛋白质组学定量分析方案。
1999年,Gygi等人用化学方法合成一种能和半胱氨酸反应的亲和试剂,称为稳定同位素编码的亲和标签,它有轻链和重链(稳定重同位素)两种形式,可以在体外标记不同状态下的蛋白质样品,酶解并用亲和柱分离纯化被标记的肽段后,再用质谱进行分析,和体内标记法一样也能够得到成对的峰表示不同样品中肽段及对应蛋白质含量的差异。这种稳定同位素亲和标签技术可以广泛地应用在细胞和组织的定量蛋白质组学分析上,提供精确的蛋白质相对定量数据。
目前ICAT方法已被商业化,应用广泛。其试剂结构如图4所示包括三个部分:头部是和巯基反应的基团,使试剂共价结合在蛋白质侧链上;中间的连接部分是同位素标记接头,分为两种:一种带8个H(d0),一种带8个D(d8);尾部是亲和标记的生物素,用于分离标记的蛋白质或多肽。目前常用的是改进的ICAT技术,称为可剪切型ICAT(cleavable
ICAT,cICAT),改用酸敏感的连接臂,降低了加到肽段上的相对分子质量从而提高了质谱检测蛋白质的覆盖率,试剂使用的标记过程也更加简便、有效。另外,第二代13C
-ICAT
试剂稳定同位素选用13C,而不是2H,这样被试剂重链和轻链标记的肽段在色谱中的保留时间更具一致性,因此定量更为精确。
但是ICAT技术每次实验只能对两个样品进行相对定量,如果要比较多组样品蛋白质表达水平的差异,将极大增加工作量和实验误差,在一定程度上限制了它的应用。
新近出现的多重元素标记的蛋白质相对和绝对定量技术(isobaric tagging for multiplexed relative
and absolute protein quantitation,iTRAQ)在一定程度上解决了这一问题。它是2004年由Applied
Biosciences公司推出的一种可以同时对四组样品进行定量分析的方法,对于实验设计比较多组样品给予了有力的支持。这种方法是建立在iTRAQ试剂的基础上,试剂的结构及质谱鉴定机理如图5所示。iTRAQ试剂是非多聚体的等质量标记试剂,是由四种试剂(114、115、116和117)组成的一组试剂,这四种试剂的分子量相同。每一种试剂都包括三部分:一个报告基团(分子量分别为114Da、115Da、116Da和117Da)、一个平衡基团(分子量分别为31Da、
30Da、29Da和28Da)和一个与肽段反应的基团。当我们需要同时比较四组不同样品时,样品分别跟四种iTRAQ试剂结合,然后混合在一起做质谱鉴定。
iTRAQ试剂作为一种新颖且使用方便的蛋白质组学定量工具,尽管在发展之初面临着软件上的问题,仍然有着其特有的优越性,并且已经在疾病标志物的寻找和不同时段或者不同状态的多样本定量分析等蛋白质组学研究领域得到了很好的应用。
图5. iTRAQ试剂结构及机理示意图
2.2 基于质谱的非标记定量技术
以上介绍的基于双向凝胶电泳的定量技术和基于质谱的稳定同位素标记定量技术由于分别有自身的缺陷,都没有得到大范围的应用。近年来科学工作者提出了一种新的不依赖于同位素标记的基于液相色谱串联质谱的非标记定量技术(Label-free
quantitative technology based on liquid chromatography tandem mass spectrometry,
Label-free LC MS/MS)的,并被越来越多的研究者认可。
现有的基于质谱的非标记定量技术主要有两种:基于一级质谱信息和基于二级质谱信息。前者的依据是与一级质谱相关的肽段峰强度(Mass
spectral peak intensity)、峰面积(Peak area)、液相色谱保留时间(LC retention
time)等信息,后者的依据是与二级质谱相关的每个蛋白质鉴定到的肽段总次数(Peptide hits或Spectral
counts)、所鉴定肽段的离子价位(Ion counts of identified peptides)等信息。William M.
Old等人比较了两类非标记定量技术的优缺点,但截止目前,label-free定量技术还在起步阶段,还没有一个较为统一的国际标准。
利用肽段数对蛋白质定量建立在已有的研究认识基础之上,就是在一个肽段混合物中,高丰度的肽段被质谱鉴定到的概率高于低丰度肽段,从而在一定程度上反映了蛋白质丰度。正是根据这一特性,Gao等利用肽段数(peptide
hits)比值来对两组样品蛋白质进行相对定量,即所谓的肽段数技术(peptide hits
technology,PHT),这种方法简单便利;另外一些科学工作者基于类似的概念称之为谱图计数(spectral
counts)来对蛋白质进行定量。
非标记定量技术的关键问题是它定量的准确性以及与现有定量方法的相关性,很多工作对此进行了讨论和研究。其中Zybailov等人用同位素标签的样品分析比较了肽段离子色谱面积定量(peptide
ion chromatograms)和谱图计数(spectrum
counting)这两种非标记定量方法,认为谱图计数定量有较高的重复性和更大的动态分布范围。Old等人也比较了谱图计数(spectrum
counting)和色谱峰面积强度(peak area
intensity)这两种定量方法,认为前者定量蛋白质差异变化的灵敏度较高,而后者的得到定量差异结果更精确一些。
总的来说,非标记定量技术不需要同位素标签做内部标准,具有经济、高通量和省时省力等优点,在蛋白质组学领域开始兴起。然而这种技术比较依赖于仪器的状态、样品的复杂性以及一些未知因素,用这些非标记定量技术去有效分析实际样品差异的工作还不是很多。尽管如此,由于其特有的优势,科学工作者还是不断的发展和完善这些非标记定量技术,相信这些非标记定量技术将会得到越来越多的应用。
相关阅读:
- ThermoFisher推出Proteome Discoverer蛋白质组学软件 (admin, 2008-6-04)
- CEM SPRINT真蛋白质分析仪Q&A (Neo, 2008-6-22)
- 蛋白质鉴定的搜索引擎和数据库 (admin, 2008-6-29)
- 研究方向墙报(二) (dicp1809, 2008-7-14)
- 新型金属离子固定化亲和色谱固定相应用于磷酸化蛋白质组学分析取得进展 (dicp1809, 2008-7-14)
- 强阳离子交换整体柱材料在蛋白质组学分析中的应用取得进展 (dicp1809, 2008-7-14)
- 10期质谱沙龙-定量蛋白组学 (longcz, 2008-7-28)
TAG: icatitraqproteomequatitativesilac