南开大学Nature子刊开发新型癌症药物载体
来自南开大学医学院的研究人员开发出了一种legumain蛋白酶激活的TAT-脂质体载体,证实利用这种新型载体可让负荷药物高效、特异性地靶向肿瘤及其微环境。这一重要的研究成果发表在6月27日的《自然通讯》(Nature Communications)杂志上。
南开大学医学院的向荣(Rong Xiang)教授和谭小月(Xiaoyue Tan)副教授是这篇论文的共同通讯作者。向荣教授致力于研究肿瘤微环境对肿瘤干细胞及肿瘤细胞分化、生长、凋亡及转移的影响,并探索新的肿瘤治疗策略。 谭小月副教授的主要研究领域包括:上皮向间充质转分化在肿瘤转移及纤维化形成中的作用;以及Vitamin D及其受体的表达在治疗纤维化以及预防肿瘤转移方面的作用。
药物在细胞内传递是药物整个传递过程的关键,许多药物尤其是抗肿瘤药必须转运至细胞质中或细胞器,如细胞核、溶酶体、线粒体等才能发挥药效,进入细胞内的药物还能使原本耐药的细胞对药物敏感。由于细胞膜的生物屏障功能,只有相对分子量小于600、非极性疏水性、脂溶性的物质才能穿透细胞膜进入细胞内,因此很多具有良好治疗功能的大分子生物活性物质在应用中受到限制。
近年来,一些称作为细胞穿膜肽(cell-penetrating peptides,CPPs) 的小分子多肽相继出现,它们拥有在不依赖膜受体情况下进入细胞质膜的能力。CPPs可有效携带远大于其自身分子质量的外源性生物活性分子穿过细胞膜进入细 胞质甚至细胞核,而不会对细胞膜产生永久性损伤,且细胞毒性低。它们通常是长约10-30个氨基酸的短肽,氨基酸序列常常带有正电荷。
人类免疫缺陷病毒HIV-1中具有一种转录活化因子TAT,它能够以一种无毒的、高效率的方式跨膜转移至细胞质甚至细胞核内。TAT作为第一个 CCPs而为众所周知。目前,在体内外实验研究中利用TAT促进抗肿瘤药及基因的细胞内转运已取得一定的进展。然而由于TAT作为药物载体,自身缺乏细胞 特异性,基于TAT的载体仍需进一步提高靶向性。
Legumain是一种天冬氨酸内肽酶,属于应激蛋白。基因表达谱及组织芯片的分析研究结 果表明Legumain在肿瘤组织及肿瘤相关巨噬细胞(TAM)中高表达,根据此现象设计的Legumain微基因肿瘤疫苗能够有效地靶向肿瘤细胞及 TAM,从而达到抑制肿瘤生长、新生血管生成及远端转移的作用。同时,以Legumain作用底物和阿霉素为主要构成部分的化疗药Legubicin能够 提高药物的靶向性及药效。
在这篇文章中,研究人员通过legumain的底物:丙氨酸-丙氨酸-天冬酰胺(AAN)附着到穿膜肽TAT上,构建出了一种新型的药物载体。他们 通过将AAN部分添加到TAT的第4个赖氨酸上,构建出了一个枝状的肽,这使得TAT的跨膜转运能力下降了72.65%。研究人员证实Legumain可 有效地催化AAN-TAT-脂质体释放出TAT-脂质体,由此恢复TAT的穿透能力。因此相比于对照转运系统,由AAN-TAT-脂质体转运多柔比星 (Doxorubicin)在提高多柔比星杀癌效应的同时,降低了它的全身性副作用。
在这项新研究中,研究人员开发出了具有特异靶向性和高效率的一种新型传递平台,从而为限制抗癌药物的毒性,提高它们在癌症治疗中的效力提供了一种新方法。
-
科技前沿

-
技术原理
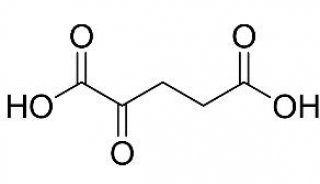
-
科技前沿
-
科技前沿