循环肿瘤细胞临床研究进展分析
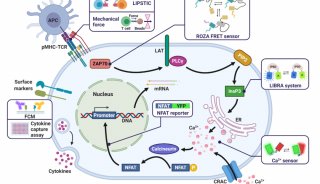
△肿瘤细胞的逃逸机制
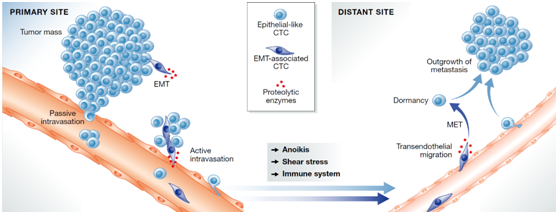
循环肿瘤细胞(CTC)是从原发性肿瘤部位“逃逸”到循环系统中,并随着血液循环和淋巴循环“定居”到其他组织部位的细胞。“定居”的CTC可以在远端器官中增殖,侵蚀正常组织。CTC可以认为是癌症组织在人体内散播的“癌症种子”,这些“种子”的生根发芽引起的癌症转移是导至绝大多数与癌症相关的死亡的重要原因。CTC的检测分析可以帮助癌症患者进行早期预后分析,确定癌症的发展阶段,并诊断性设计治疗方案。
与传统的实体肿瘤组织活检相比,CTC的检测或液体活检有两个优势:"01 CTC的检测或活检是非侵入性的。CTC的检测或活检只需采集患者的外周血样本即可进行。验血容易,安全,不容易受患者主观意愿影响。02 CTC的检测或活检可以随时间采集多个样本,根据采集到的CTC反映的癌症进展信息可以适当调整癌症的治疗方案。"
相对而言,对实体瘤的分析需要侵入性手术,采集样本比较繁琐,风险更大。但是另一方面,CTC在外周血中的数量非常稀少,通常每毫升血液中只有几个细胞存在,这提高了CTC的检测难度。此外,CTC的表面标记个体差异较大,这使得开发高灵敏度和特异度的检测技术难度极大。
-1-
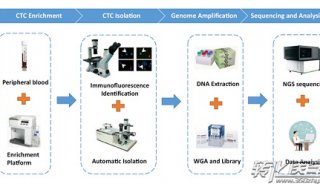
CTCs的检测方法
免疫细胞化学
(immunocytochemistry,ICC)
ICC利用抗原抗体结合的反应原理,首先使用单克隆抗体与特异性的肿瘤标志物反应,然后通过酶底物反应显色来判断肿瘤细胞的存在。CTC的标志物主要分为三类(1)上皮细胞角蛋白(CK),最常用的CK蛋白是CK19;(2)上皮细胞膜特异性抗原,最常见的是EpCAM;(3)肿瘤相关糖蛋白(TAG)。通常CTC的ICC特异性标志是EpCAM+CK+DAPI+CD45-;而白细胞的标志是EpCAM-CK-DAPI+CD45+。通过ICC可以将CTC从大量的淋巴细胞悬液中分离出来。ICC的优点是能够分离出CTC并保持细胞形态;然而由于CTC的异质性,其细胞表面抗原不均一,导至ICC对CTC的检测并不敏感。
流式细胞术(flow cytometry,FCM) FCM同样是利用抗原抗体结合的反应原理来筛选细胞的。流式细胞术可以将单克隆抗体制作称为荧光探针,通过荧光探针与CTC的特异性表面抗原来标记CTC。通常使用的荧光抗体是EpCAM和CD45。FCM的优点是可以在鉴定CTC的同时,检测细胞形态和进行DNA倍数分析。其缺点是需要大量的血液样本才能满足FCM检测的统计学要求,另外FCM检测CTC同样受制于CTC的表面特异性抗原的异质性。
反转录聚合酶链式反应(RT-PCR)
RT-PCR的原理是利用逆转录酶将肿瘤特异性mRNA序列逆转录为DNA,然后通过PCR反应扩增特异性的DNA片段,从而检测血液样本中是否存在CTC特异性的mRNA。通常情况下,在CTC的特异性mRNA的选择上主要有以下几种途径:(1)某些基因改变后RNA水平的异常表达,例如p53、ras的点突变,BRCA1、BRCA2的缺失突变,CD44产生异构体、某些基因异常扩增(ERBB2,EGFR)等;(2)组织特异性标志的mRNA如mucin,cytokeratin,ER,maspin;(3)肿瘤特异性标志mRNA,如CEA,β-HCG等。RT-PCR的检测CTC的优点是灵敏度高、重复性好、价格低廉;其缺点是mRNA的表达具有不稳定性、检测过程必须破坏CTC、假阳性率高。
-2-
CTCs的富集方法
基于细胞物理特异性的富集方法
通常CTC的大小、密度和电学特异与外周血的其他细胞有显著的差异,通过这些差异可以设计出相应的CTC的分离方法。(1)利用CTC的大小和机械性能分离CTC,其主要原理是CTC的体积约在15-30μm,而普通的细胞的直径在8-11μm的范围内,通过使用微孔滤膜、尺寸依赖的微流控芯片就可以将CTC从外周血中分离出来;(2)利用CTC的细胞密度的特异性,通过Ficoll密度梯度离心将CTC从单个核细胞中分离出来;(3)利用CTC的电学性能的特异性,通过电旋转或者双向电泳,可以将CTC从外周血分离出来。这种方法捕获的CTC能够保持较高的捕获效率,并且保持细胞的活性。
基于CTC的分子生物学特性 CTC具有特异性的表面marker分子,通过这些特殊的marker设计分离磁珠,可以同时对CTC进行分离和检测。免疫磁珠分选CTC主要有直接捕获的阳性富集法和去除其他细胞的阴性福激发。其主要原理是针对CTC表面主要表达的上皮细胞黏附分子(如:EpCAM)、细胞角蛋白(如:CK19)和肿瘤特异性抗原(如:HER2)使用交联特异性抗体的免疫磁珠从外周血中捕获CTCs。最典型的是Cell
Search系统,利用免疫磁珠捕获细胞,在使用FCM和ICC对细胞进行鉴定和计数。这种方法的优点是方便、有效、分离的CTC纯度高,并且能保持细胞活性。其缺点是价格昂贵、检测敏感性受CTC表面抗原表达的制约,并且CTC经过EMT后,其EpCAM等分子会丢失。
-3-
CTC的临床意义
体外早期诊断:通常的肿瘤的影像学诊断在癌症的初期很难诊断出来。但是循环肿瘤细胞可以在癌症的早期即可在血液中检测到。因此循环肿瘤细胞可以作为癌症早期筛查比较有潜力的指标。根据循环肿瘤细胞个数进行患者预后生存时间:大量的研究表明,循环肿瘤细胞可以作为癌症预后生存时间的有效指标,其灵敏度要高于常见的影像学诊断。癌症治疗的疗效评估:通常情况下,癌症病人在接受癌症治疗后(放疗、化疗、免疫治疗)的三个月后评估癌症患者的治疗效果。通过CTC检测可以在治疗后的几周内反应癌症患者的肿瘤状况,这样可以及时地对癌症疗法进行评估和反馈,从而针对性地尽快进行下一步的治疗方案的设计。
-4-
CTC的研究现状
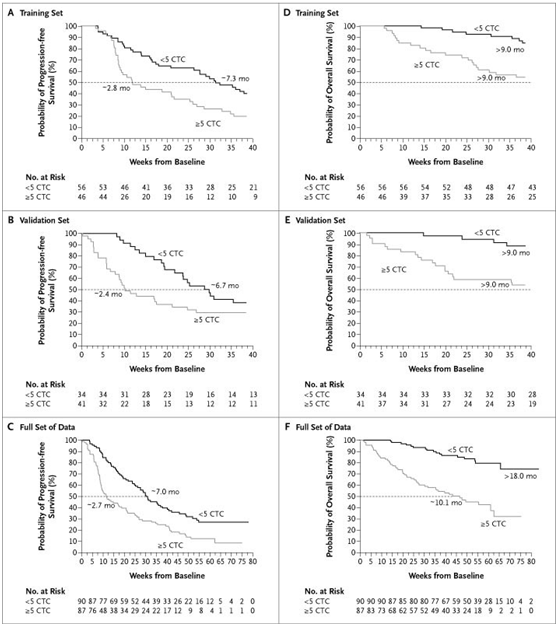
2004年发表在新英格兰上的一项多中心研究中[1],研究者对177例转移性乳腺癌患者的循环肿瘤细胞水平进行了测试。实验组中循环肿瘤细胞水平等于或高于每7.5
ml全血5的患者,与每7.5 ml全血中肿瘤细胞少于5的组相比,其中位无进展生存期更短(2.7 个月vs. 7.0个月,P
<0.001)且总生存期也更短(10.1个月vs.> 18个月,P
<0.001)。在开始治疗后的首次随访中,两组之间的这种差异持续存在(无进展生存期:2.1个月vs. 7.0个月,P
<0.001;总生存期:8.2个月vs.> 18个月,P <0.001
),且预后不良的患者比例从49%降低到30%,表明治疗有益处。多元Cox比例风险回归表明,在统计模型中的所有变量中,基线和首次随访时循环肿瘤细胞的水平是无进展生存期和总生存期的最重要预测指标。转移性乳腺癌患者治疗前CTC水平是有效的预后预测因子。CTC计数小于5的患者无进展生存期(PFS)和总生存期(OS)均显著高于CTC计数大于等于5的患者(Figure
1)。
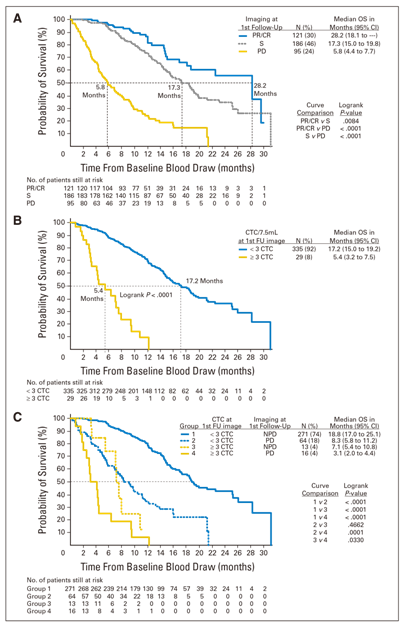
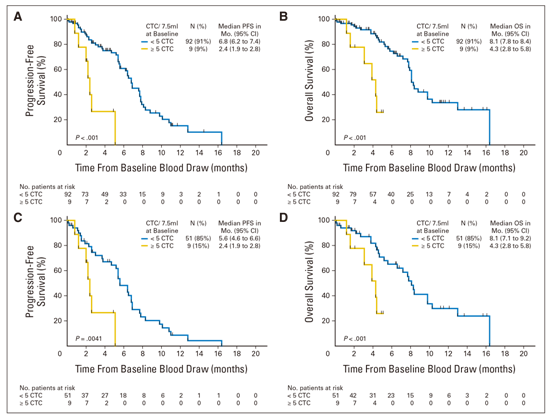
△Figure 2 (A) Overall survival in metastatic colorectal cancer patients by imaging response,(B) circulating tumor cell (CTC) yield within±1 month of imaging, and (C) both imaging response and circulating tumor cell yield within ±1 month of imaging. Overall survival (OS) values were calculated from the time of the baseline blood draws. PR, partial response; CR, complete response; S, stable disease; PD, progressive disease; FU, follow-up. 2011年发表在J Clin Oncol.的一项针对非小细胞肺癌(NSCLC)的循环肿瘤细胞的研究中[3],研究者对101例未接受过治疗的III期或IV期NSCLC患者进行了标准治疗前后的CTC分析。结果表明IV期NSCLC患者(n = 60;CTC数量范围从0至146)的7.5 mL血液中的CTC数量高于IIIB期(n = 27; CTC数量范围从0至3)或IIIA期疾病(n = 14;未检测到CTC)。在单变量分析中,少于5个CTC的患者与化疗前5个或更多CTC的患者的无进展生存期为6.8 v 2.4个月,P <.001,而总生存期(OS)为8.1 v 4.3个月,P <.001。在多变量分析中,CTC数量是OS的最强预测指标(危险比[HR]为7.92;95%CI为2.85至22.01;P<.001),并且通过在一个化疗周期后采集的第二个CTC样本,可以增加HR的点估计值(HR=15.65;95%CI,3.63~67.53;P <.001)(Figure 3)。
△Figure 3 Kaplan-Meier curves for (A, C) progression-free survival (PFS) and (B, D) overall survival (OS) of patients with < five and ≥ five circulating tumor cells (CTCs) in 7.5 mL of blood at baseline, including (A, B) analysis of all patients (N = 101) and (C, D) analysis of patients with stage IV disease only (n = 60). Reference
M.Cristofanilli, G.T. Budd, M.J. Ellis, A.T. Stopeck, J. Matera, M.C. Miller,J.M. Reuben, G.V. Doyle, W.J. Allard, L.W.M.M. Terstappen, Circulating tumorcells, disease progression, and survival in metastatic breast cancer, The NewEngland Journal of Medicine, 351 (2004) 781-791.
S.J. Cohen, C.J.A. Punt, N.Iannotti, B.H. Saidman, K.D. Sabbath, N.Y. Gabrail, J. Picus, M.A. Morse, E.P.Mitchell, M.C. Miller, Relationship of Circulating Tumor Cells to TumorResponse, Progression-Free Survival, and Overall Survival in Patients WithMetastatic Colorectal Cancer, Journal of Clinical Oncology, 26 (2008)3213-3221.
M.G. Krebs, R. Sloane, L.Priest, L. Lancashire, J.-M. Hou, A. Greystoke, T.H. Ward, R. Ferraldeschi, A.Hughes, G. Clack, M. Ranson, C. Dive, F.H. Blackhall, Evaluation and PrognosticSignificance of Circulating Tumor Cells in Patients With Non–Small-Cell LungCancer, Journal of Clinical Oncology, 29 (2011) 1556-1563.
-
项目成果
-
综述

-
焦点事件
-
产品技术

-
焦点事件

-
项目成果
-
科技前沿

-
产品技术

-
综述

-
科技前沿

-
企业风采

-
科技前沿

-
科技前沿

-
技术原理
-
焦点事件

-
焦点事件

-
项目成果
-
技术原理
-
综述
-
技术原理
-
焦点事件

-
科技前沿
-
项目成果
-
项目成果
-
项目成果
-
项目成果
-
项目成果
-
项目成果
-
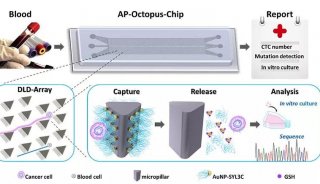
项目成果
-
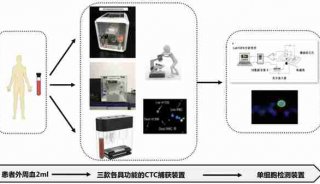
科技前沿
-
焦点事件