两篇Nature文章:揭示自噬调控新机制
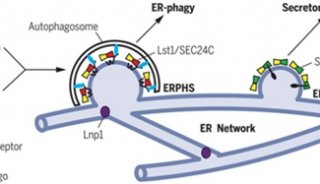
在饥饿时期,细胞会通过改变它们的状态来将投入到生物合成的能量减到最少,转而激活分解代谢途径将细胞内的储存物转化成能量以维持生存。这种适应需要自噬。自噬是将细胞内的物质输送到称作为溶酶体的亚细胞结构中,然后将其降解进行回收利用的过程。尽管一直以来人们都认为自噬的潜在调控机制是一种转录后调控,近期的一些研究揭示转录网络也在这一过程中起作用。
在发表于11月12日《自然》(Nature)杂志上的两篇新研究论文中,来自美国伊利诺伊大学香槟分校和Baylor医学院的两个独立研究小组,描述了从前未知的一个响应营养供应来调控自噬的转录机制。研究人员证实,一些核受体蛋白通过控制自噬基因的表达调控了自噬。
这一自噬调控新图像提供了有关短期和长期反应的一个双相机制。在细胞质中,一些翻译后蛋白质修饰和蛋白质间的互作介导快速诱导了这一信号通路,但核转录机制是持续反应的必要条件。这样的转录调控确保了在缺乏营养的长时期内生成适当量的溶酶体形成和自噬必需的一些蛋白质。
FXR是一种在正常摄食情况下活化的核受体蛋白,其调控了胆汁酸、脂质和葡萄糖代谢。利用一些小鼠模型和药理学方法,伊利诺伊大学香槟分校和Baylor医学院的研究小组证实,FXR是肝脏中自噬的一个抑制蛋白,这是首个直接的证据证实核受体与自噬之间存在联系。但两项研究报道了这种抑制的两个不同的潜在机制。
伊利诺伊大学香槟分校的Sunmi Seok和同事们发现,活化的FXR通过抑制CREB的转录活性而阻断了自噬。CREB蛋白可促进几个自噬基因表达。FXR通过破坏CREB与其辅激活蛋白CRTC2之间的功能互作介导了这一抑制。相比之下,Baylor医学院的Jae Man Lee和同事们证实,FXR直接结合到调控几种自噬基因表达的启动子-DNA区域,导致了对它们的抑制。
值得注意的是,Lee等证实FXR结合到了称作为DR1位点的一些区域的启动子DNA上,而核受体蛋白PPAR-α也可以结合这些位点。像FXR一样,PPAR-α也参与了脂类代谢,但不同于FXR的是PPAR-α是被禁食所激活,促进了肝脂肪酸降解生成能量。作者们发现,PPAR-α诱导了一些自噬基因表达,而FXR抑制了它。因此两个因子通过竞争DNA上的相同结合位点,对立地调控了响应营养供应的自噬反应。
两篇论文提出的机制之间所存在的明显不一致,有可能反应了响应营养水平、参与调控自噬的这一机器的复杂性。FXR有可能通过许多的机制抑制转录来微调了自噬。并且,FXR和CREB只共同结合了其中部分的DNA位点,支持了这种可能性:即在正常的摄食条件下FXR可通过CREB非依赖性的机制来抑制自噬。也有可能报道的两种机制响应了不同的营养信号差异性地激活。
表达直接或间接受到FXR/CREB和PPAR-α控制的自噬基因数量相当的多,其中一些基因还与几个自噬步骤相关。例如,Seok等发现CREB 通过直接转录激活TFEB蛋白——这一溶酶体生物合成和自噬的主要调控因子诱导了自噬。TFEB还促进了PPAR-α的表达及活性,由此激活了肝脏中的脂质降解信号通路。
因此,这些研究结果表明了CREB和TFEB,以及核受体蛋白FXR及PPAR-α均属于同一转录网络。这一网络受到营养物的调控,并控制了自噬。这一转录程序在细胞核中起作用,并与调控快速诱导自噬的细胞质信号通路密切关联。在摄食情况下,营养物质传感激酶、饥饿诱导自噬的主要调控因子 mTORC1,通过将TFEB留在细胞质中介导了这些互作,而在禁食期间其允许了TFEB入核,并以相反的方式调控了PPAR-α的转录抑制蛋白 NCoR1入核。
以往的研究曾证实自噬在脂质降解中起作用——在一个称作为噬脂(lipophagy)的过程中,脂滴被纳入到自噬囊泡中,随后传送到溶酶体进行降解。在不同的细胞区室如细胞核、溶酶体、自噬囊泡和线粒体中起作用的各种脂质降解机制需要一个整合的调控网络。当前的两项研究清楚地表明了,FXR和 PPAR-α在转录水平上调控了噬脂。
了解到自噬和核受体之间的关联,增进了我们对于自噬系统的认识,因为一些核受体参与了许多的信号通路。还需要更多的研究来全面地了解不同的生理和病理情况是如何调控这一过程的。此外,仍然需要确定介导了饥饿反应的一些转录机制,是否也被用来响应了其他需要能量的状况,例如体育锻炼和低温,或是诸如癌症等疾病。最后,用药物调控这些信号通路有可能为对抗广泛的疾病指出了一些可能的治疗策略。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 4620
询底价 Tel:400-6699-117 转 4620 -
仪器推荐

-
项目成果