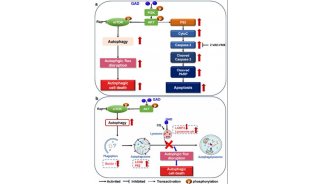
自噬性死亡的自噬机制
细胞为维持正常新陈代谢,其生长过程始终都有自噬现象,这已在形态学中得到证实。但自噬的消长受多种因素影响,营养缺乏、胰高血糖素可诱导自噬,胰岛素抑制自噬,细胞肿胀也同胰岛素一样有抑制自噬的作用,它们的作用点在于改变氨基酸的浓度。当氨基酸浓度降低时,自噬启动可产生氨基酸,保证器官成活;相反则自噬被抑制。与酵母相似,在哺乳动物细胞中,自噬高度依赖于磷酸化事件。在哺乳动物肝细胞中,核糖体蛋白S6 的磷酸化可以刺激蛋白合成,增加核糖体与内质网的黏附,从而抑制自噬。氨基酸通过激活p70S6 蛋白激酶,也可以使核糖体蛋白S6 磷酸化增加而抑制自噬,磷酸酶抑制剂冈田酸对蛋白磷酸酶的效应也抑制了自噬过程。而且,各种类别的磷脂酰肌醇-3-激酶(PI3K)用独特的方式控制自噬途径:IA 类的PI3K 抑制细胞质的汇集和降解,而Ⅲ
类则刺激细胞质的降解,提示PI3K 家族是自噬途径关键的调控因子。最近的研究表明,死亡相关蛋白激酶(DAPk)和DAPk 相关的蛋白激酶(DRP-1)的表达,触发2 个重要的非caspase 依赖的细胞质事件:膜的出泡生长(见于任何形式的细胞死亡)以及增殖的自噬(典型的自噬特征)[20]。在自噬小泡中发现DRP-1,表明这一激酶直接参与到自噬过程中。另已有研究结果表明,beclin-1 可能是哺乳动物用于自噬的基因,它通过这一死亡过程的活化抑制肿瘤的形成[21]。自噬过程中,自噬体形成后将其包裹物运输至溶酶体降解,这一过程并非简单的扩散,而是通过
细胞骨架微管网络系统的传输来实现的。当使用微管解聚和抑制剂时,可见到自噬体的解聚以及阻止其与溶酶体的融合。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 4620
询底价 Tel:400-6699-117 转 4620 -
仪器推荐

-
科技前沿

-
项目成果
-
项目成果