Nature:癌症代谢,过犹不及
一种受到严密调控的酶在癌细胞中平衡了能量生成和来自葡萄糖的大分子合成。通过促进这种酶的活性来打乱这种平衡能够抑制小鼠体内肿瘤的生长。
癌症的形成与支持肿瘤细胞增殖活力和生物合成需求的一套代谢改变相关。其中许多的改变是由驱动肿瘤形成的相同遗传突变所激发,这表明通过药理学方法使这些肿瘤细胞代谢正常化可以抑制癌症的进程。糖酵解是生成能够和大分子前体的一条细胞信号途径。糖酵解增强是癌症的一个典型的代谢标志,这使得糖酵解信号通路成为了一个有吸引力的靶标。
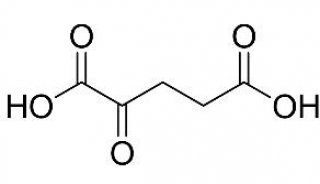
近期来自贝斯以色列女执事医疗中心的Anastasiou证实靶向肿瘤细胞中一种常见形式的丙酮酸激酶能够重新分配葡萄糖源性代谢物的命运远离生物合成途径,由此抑制了小鼠中的肿瘤生长。
糖酵解信号生成细胞主要的能量转移分子――ATP的能力很大程度上依赖于丙酮酸激酶的活性。哺乳动物有各种形式的丙酮酸激酶,肿瘤细胞通常表达M2 亚型(PKM2),相比其他的丙酮酸激酶PKM2显示降低的酶活性。最初这被认为在癌细胞中有些自相矛盾,癌细胞充分地表达葡萄糖载体和糖酵解酶,协同增进整体糖酵解。但在另外一条活性信号的尽头,这一薄弱环节的利益在于促使了一些生成的中间产物累积,类似于一个流体柱底部的闭合阀门。现在研究人员认为这一阀门后代谢物的积聚可能促进了它们转移至旁路,包括生成大分子构件,其他细胞复制所需的底物。
当证实用更加具有活性的PKM1亚型替代癌细胞中的PKM2导致了小鼠体内更高的丙酮酸激酶整体活性,但减少了大分子合成和肿瘤生长时,对于癌症中 PKM2作用的解释获得了动力。一些研究更进一步的支持表明许多在癌细胞中调控PKM2的进程,例如通过酪氨酸磷酸化蛋白结合这种酶,似乎减少而并非促进了它的酶活性。
癌细胞糖酵解的这一图像,一种可能的意义是促进PKM2活性――实际上,打开了阀门――有可能是通过减少对大分子前体的利用而损害了肿瘤生长。 Anastasiou检测了这一观点,利用小分子夹紧该酶至一个高度活化的四聚体构象(一种复合物包括酶的四个亚基),随后分析了肿瘤细胞的糖酵解。他们发现细胞葡萄糖依赖的生物合成中间产物库被耗尽,由它们供应的通过信号通路的流量受到抑制。用PKM2活化剂分子处理也减少了经受低氧水平的癌细胞的增殖。最后,当作者们通过口服给予PKM2活化剂处理带瘤小鼠时,他们发现肿瘤中生物合成中间产物的水平受到抑制,实际上减慢了肿瘤生长。重要的是,小分子还导致了PKM2对酪氨酸磷酸化蛋白的阻断不敏感,表明这些药物有可能在编程减少丙酮酸激酶活性的肿瘤中提供了持久的代谢效应。
这些PKM2激活的研究为更广泛地研究代谢和癌症生物学提供了基础。Anastasiou和同事们的研究结果表明PKM2以更加精细的方式影响了生物合成。例如,他们发现激活PKM2减少了从葡萄糖代谢到脂肪酸合成一条被视为参与了丙酮酸盐(一种糖酵解中间产物分子)形成的信号通路的流量。总之,这些新数据表明次于最大的PKM2活性有助于引导代谢产物进入生物合成信号。它借助了一种并不仅仅涉及中间产物累积的机制,只是目前尚未获得完全的理解。测试通过PKM2激活或其他机制调节糖酵解是否可以延伸到在正常水平条件下抑制细胞增殖将会是有趣的,因为这样的抑制也是充满氧的肿瘤快速生长区域所需要的。
推动了解PKM2的功能,现在操控它来抑制肿瘤生长,表明了癌症代谢研究焦点的转变。从上世纪20年代Otto Warburg关于肿瘤糖酵解的早期试验开始,该领域的工作主要集中于肿瘤生成能量的机制。然而近期的研究获得了癌细胞中代谢网络更广阔的视野,从而导致了更深入地了解生物合成、氧化还原动态平衡和支持细胞生存和增殖的代谢的其他方面的复杂性。这些研究揭示了代谢在细胞信号和基因表达调控中许多意想不到的作用,将代谢酶的范围延伸到基本上细胞生物学的每个领域。这些新发现的功能域癌症高度相关。例如,PKM2也充当了基因表达的激活子,这使得它具有不依赖于酶功能的增殖促进活性。
最后,Anastasiou等证明了肿瘤代谢调控中的一个重要概念。他们表明激活的PKM2抑制了细胞增殖,但严重抑制这种酶已知具有相似的效应,可在小鼠中诱导肿瘤消退。有可能细胞增殖的最高程度是促成生物合成的代谢网络受到精细调控的结果,但最大程度的激活会适得其反。这些节点或许是在代谢网络中最容易受到破坏的控制点,鉴别它们应该会为癌症中的代谢治疗提供最好的机会。
-
技术原理