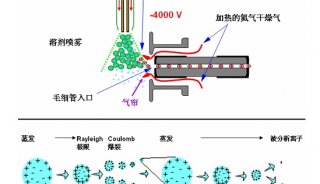
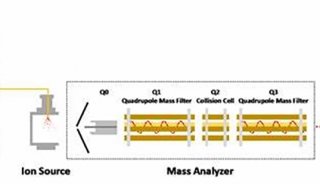
液质联用法测定牛奶中5种β-内酰胺类抗生素
液质联用法测定牛奶中5种β-内酰胺类抗生素
随着我国经济发展水平和生活水平的提高,牛奶逐渐成为中国城市居民日常生活中必不可缺的主要膳食成分之一。随之而来的牛奶中的抗生素残留问题也日益受到政府的重视。β-内酰胺类抗生素被广泛应用于兽药中,该类兽药的残留会引起敏感人群过敏。经常饮用含有残留抗生素的牛乳会诱导产生耐药菌株,给人类带来潜在的危害。欧盟和美国FDA等对上述抗生素的残留量都有严格的规定(表1),并都有年度残留的监控计划。
对牛乳中β-内酰胺类抗生素残留的分析较多的是采用传统的微生物法及高效液相色谱法(HPLC)等。HPLC法[1,2]常常需要衍生化反应,衍生化效率难于控制,其重现性不是很好。Sonja Riediker等[3]及Holstege等[4]分别采用LC―MS测定牛奶中内酰胺类抗生素残留,但前者的方法中操作步骤较繁琐,后者采用的内标是有可能存在的同类抗生素。我们参考两者的测定方法,研究建立了牛奶中5种残留抗生素的测定方法。
1 实验部分
1.1 主要仪器、试剂与材料
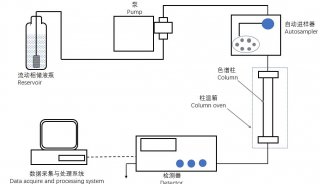
Waters 2695-Quttro Primier高效液相色谱仪-质谱仪;色谱柱为Waters 公司的Atlantis C18 (150 mm×2.1 mm,3.5 μm)色谱柱;离心机( 瑞江RJ-TDL-5A);氮吹仪( ZymarkTurboVap LV EVAPORATOR);固相萃取仪(SUPELCO Visi PREP DLTM);Milli―Q超纯水器(美国Milliporeco公司); IKA MS1型旋涡混合仪;固相萃取柱(Waters oasis HLB 3cc)。
标准品阿莫西林、氨苄西林、青霉素、氯唑西林钠、苯唑西林钠(纯度为99% )及同位素内标(青霉素-D7)均购自Dr. Ehrenstorfer 公司。
标准储备液的配制:分别称取阿莫西林、氨苄西林、氯唑西林钠、苯唑西林钠及青霉素G各10 mg,用水溶液溶解并定容至10 mL。各储备液浓度均为1.0 mg/mL。于冰箱中-20℃储存。青霉素-D7内标溶液的配置:准确称取10 mg内标,用50%甲醇定容至10 mL棕色瓶中,混匀,于冰箱中-20℃储存。乙腈、甲酸及磷酸二氢钠均为分析纯。牛奶为市售产品。
1.2 实验方法
1.2.1 样品的处理 取5 mL牛奶置于50 mL离心管中,加入20 μL浓度为1 μg/mL的内标物,加入5 mL乙腈并涡旋1 min,再加入10 mL乙腈,充分摇匀,然后3 000 rpm离心5 min。吸取上层清液10 mL于60℃下用氮气吹近干,加入3 mL磷酸盐缓冲液(pH=4.5)。超声溶解。将该溶液注入平衡好的HLB(先用3 mL甲醇洗涤小柱,然后再用3 mL水淋洗),先用水淋洗,然后用3 mL60%乙腈洗脱。收集洗脱后氮吹至干,用0.5 mL乙腈∶0.1%甲酸水(1∶1)溶解,15 000 rpm离心,上清液供液相色谱-质谱仪进行检测。
1.2.2 色谱条件 柱温:25℃; 进样量:10 μL;流速:0.2 mL/min;样品运行液相条件:A为0.1%甲酸水溶液,B为乙腈溶液;0~ 2 min ,A的浓度为98%;2~15 min,A的浓度降至55%;15~25 min,A的浓度为10%;28.5 min开始,A的浓度回复至98%;自动进样器进样,采用等梯度洗脱方式。
1.2.3 质谱条件 电离源:ESI;电离模式: 正离子模式;毛细管电压:3.2 kV;源温度:100 ℃;脱溶剂温度:450 ℃;脱溶剂气流量:500 L/h;电子倍增电压:650 V;碰撞室压力:1.0×10-4mbar;分析器低端分辨率:13.5 V;高端分辨率:13.5 V;优化锥孔电压及碰撞电压,使定量或定性的离子碎片的丰度达到最大。5种抗生素色谱和质量条件及参数见表2。
2 结果与讨论
2.1 色谱条件的优化
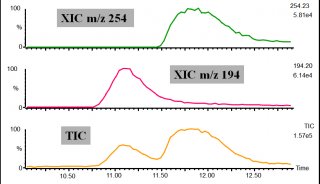
曾尝试了SunfireC18和Symmetry C18和Discovery C18(均为150 mm×2.1 mm, 3.5 μm)等色谱柱,尽管这些色谱柱也能分离这些化合物,但对于出峰最早的阿莫西林的保留都不是十分满意。阿莫西林可能是这些水溶性化合物中极性最强的物质,在其他色谱柱比较难以保留,而Atlantis色谱柱对于极性强的亲水化合物具有特别的吸附能力,极大地改善了阿莫西林在其他色谱柱出峰早保留短暂的现象, 使阿莫西林在色谱柱也有很好的保留,且得到的色谱峰型较尖锐。所以最终选择了 Waters公司的Atlantis C18色谱柱。在流动相的选择过程中,曾比较不同梯度的甲醇、水体系,乙腈、水体系,后者的分离效果及柱压明显好于前者,因此选择了乙腈、水体系。为了增强分离效果及提高质谱中的离子化效率,对比了甲酸、乙酸、三氟乙酸等,最终确定了0.1%甲酸水、乙腈体系。在上述选定色谱测定条件下,药物峰与干扰峰可获得良好分离(图1)。
2.2 样品提取条件的选择
参考文献〔3〕、〔4〕的提取方法,比较了磷酸盐缓冲液、乙腈等两种溶剂的提取效果,尤其对阿莫西林的提取,乙腈的提取效果优于磷酸盐溶液。同时还比较了不同的固相萃取柱HLB、MCX、MAX对待测物的净化效果,HLB柱的处理效果最好。在洗脱HLB色谱柱时,比较了乙腈的比例为40%、60%及80%时的洗脱液,60%的洗脱液已足以将HLB柱上的待测物洗脱干净。
2.3 线性范围、线性回归方程及定量限
校正曲线的制作:分别吸取浓度为1 μg/mL的5种标准品的混合标准溶液10、15、20、25、50、100 μL,加入到5 mL的牛奶中,并分别加入1 μg/mL的内标溶液20 μL,以下步骤与样品的处理方法相同。其标准系列浓度分别为2、3、4、5、10、20 ng/mL,依次进样,进样量均为10 μL,以标样浓度为横坐标,标样峰面积与内标峰面积的比值为纵坐标,分别作标准工作曲线,其相关系数及回归方程见表3。在2~20 ng/mL的范围内待测物的峰面积与内标峰面积比与浓度呈现良好的线性相关性,线性相关系数(R2 )为0.9943~0.9981。以信噪比S/N≥10作为确定最低定量限的标准,阿莫西林、氨苄西林、青霉素、氯唑西林、苯唑西林的最低定量限分别为5、2、2、4、4 μg/L。
2.4 精密度试验
以牛奶加标样作为阳性试样,做10次重复试验,分别进样10 μL,计算结果见表4。
2.5 回收率测定
分别取样5份,加入20 μL浓度为1 μg/mL的内标物,按上述处理方法进行测定,分别测量5份加标牛奶中待测物质与内标的峰面积比,并计算出各加标样品的回收率。样品中5种抗生素的添加水平分别为5、10 ng/mL。在牛奶中提取回收率为88.4%~126.6%。相对标准偏差(RSD)均<13.0%(表5)。
2.6 样品测定
利用以上建立的方法,测定了从超市中购买的光明、优倍、优佳等品牌的牛奶,均未检出以上抗生素。图2为优倍牛奶的MRM谱图。
2. 7 标准贮备液与样品的稳定性
标准贮备液应存放在-20℃冰箱中,有效期限为1个月。新鲜的牛奶如需保存,最好分份并冷冻保存。
2. 8 牛奶中的干扰物实验
利用本文中的处理方法处理了市售的数种无抗奶,仅发现某些牛奶中在阿莫西林出峰的位置有少许干扰峰出现,但并不影响阿莫西林的测定。