复旦大学Cancer Res发表癌症新文章
来自复旦大学、加州大学圣地亚哥分校、北卡罗来纳大学等机构的研究人员在新研究中证实,氧化应激可促进SIRT2与磷酸甘油酸酯变位酶2(PGAM2)互作,由此刺激PGAM2脱乙酰基化并激活PGAM2。这一研究发现发表在5月1日的《癌症研究》(Cancer Research)杂志上。
任职于复旦大学和北卡罗来纳大学的熊跃(Yue Xiong)教授是这篇论文的通讯作者。因其杰出的科学成果熊跃教授曾获得“美国癌症协会青年研究人员奖”,“Pew学者奖”,“美国国防部乳腺癌研究职业发展奖”, 以及“美国癌症研究协会Gertrude B. Elion研究奖”等奖励。目前的研究领域为肿瘤和干细胞周期调控、乳腺癌小鼠动物模式和蛋白泛素化。
糖酵解过程被认为是生物获取能量的一种最古老、最原始的方式。糖酵解过程中涉及到许多的酶,如醛缩酶、3磷酸甘油脱氢酶、磷酸甘油酸变位酶(PGAM)、烯醇化酶等。其中,PGAM是糖酵解和葡萄糖异生通路中的一种重要的酶,其在协调能量生成、还原力(reducing power)产生、核苷酸前体及氨基酸的生物合成中发挥重要的作用。以往的研究表明,采用小RNA干扰或是小分子抑制PGAM可以减少细胞的增殖和生长。尽管已知在一些肿瘤细胞中PGAM的活性常常上调,目前对于其调控机制却仍然知之甚少。
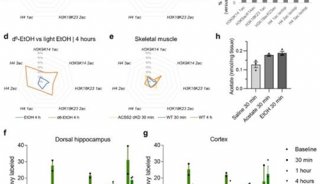
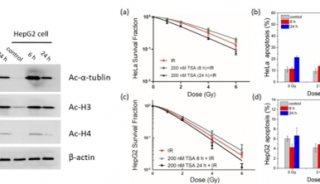
在这篇文章中,研究人员报告称发现PGAM的赖氨酸100(K100)位点可发生乙酰化。这一活性位点残基保守地存在于细菌、酵母、植物和哺乳动物之中。他们在果蝇、小鼠、人类细胞以及多个组织中检测到了K100乙酰化,证实其降低了PGAM2的活性。而细胞质蛋白SIRT2则可以使得PGAM2脱乙酰化并激活它。
研究人员发现,提高活性氧簇(ROS)的水平可通过促进PGAM2与SIRT2互作,来刺激PGAM2脱乙酰化,激活PGAM2。当他们用一种乙酰化模拟突变体K100Q来替代内源性的PGAM2时,发现细胞NADPH生成减少,细胞增殖和肿瘤生长受到抑制。
这些结果揭示出了响应氧化应激的一个PGAM2调控及NADPH稳态机制,这一机制影响了细胞的增殖和肿瘤生长。