清华大学Cell子刊开发蛋白质研究新工具
来自清华大学生命科学学院的研究人员称,他们开发出了一种“Clickable”探针分析大肠杆菌和果蝇中心细胞代谢中蛋白质的谷胱甘肽化。这一重要的研究结果发布在11月19日的《Chemistry & Biology》杂志上(延伸阅读:两篇Science文章:改变蛋白质研究的强大工具 )。
论文的通讯作者为清华大学生命科学学院的邓海腾(Yan Gao)教授,其主要研究领域为发展和应用蛋白质组学,代谢组学,和化学生物学的技术和方法。
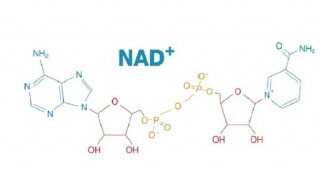
蛋白质上特定氨基酸残基的可逆性翻译后修饰,能有效地调节蛋白质的功能;最常见的翻译后修饰就是蛋白质的磷酸化与去磷酸化。近年来,另一种重要的蛋 白质翻译后修饰——谷胱甘肽化(Glutathionylation)日益引起人们的重视,即蛋白质上的半胱氨酸残基和谷胱甘肽(GSH)形成混合型二硫 键。
早期的研究显示,氧化应激状态能刺激体内蛋白质和GSH发生氧化反应而产生大量谷胱甘肽化蛋白质。所以过去人们一直侧重研究谷胱甘肽化修饰在氧化应 激中的作用,并且发现它是细胞内蛋白质半胱氨酸巯基免受不可逆性氧化损伤的一种保护机制。现在,越来越多的证据证实,蛋白质谷胱甘肽化调控了包括能量代 谢、信号转导和蛋白质稳态等许多的细胞过程。全面分析谷胱甘肽化蛋白质对于了解氧化还原调控的信号转导具有至关重要的意义。
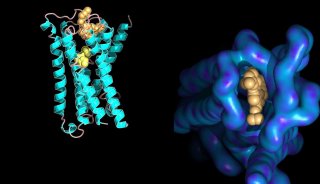
在这篇文章中研究人员报告称,他们开发出了一种基于点击反应(click reaction)和蛋白质组学的新方法在大肠杆菌和果蝇裂解物中富集和鉴别谷胱甘肽化蛋白肽,由此分别鉴别出了937和1,930个潜在的谷胱甘肽化蛋 白肽。生物信息学分析显示靠近负电荷氨基酸残基的半胱氨酸残基有较高频率谷胱甘肽化。重要的是,他们发现大多数与代谢信号相关的蛋白质都发生了谷胱甘肽 化,在不同的物种间代谢酶的谷胱甘肽化位点高度保守。
新研究结果表明,这一谷胱甘肽类似物是一种可用来确定蛋白质谷胱甘肽化特征的有用工具,在调控细胞代谢中发挥重要作用的代谢酶的谷胱甘肽化在物种间保守。