罗氏终止糖尿病新药III期试验 提示开发PPAR药物需谨慎
近日,制药巨头罗氏宣布,将暂停糖尿病药物aleglitazar的研发工作,部分原因是该药存在严重副作用。这对于志在拓展产品线的罗氏是一个沉重打击;另外,由于aleglitazar属于过氧化物酶体增殖物激活受体(PPAR)激动剂类药物,这也提示PPAR药物研发存在巨大风险,研究人员开发PPAR药物需谨慎。
aleglitazar止步III期试验 罗氏再度受创
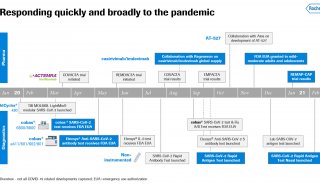
2009 年罗氏在美国糖尿病协会会议上发布了aleglitazar的临床实验数据,数据表明,与安慰剂和武田公司同类畅销药Actos相比较,aleglitazar的疗效毫不逊色。此外,在332名患者参加的一项II期临床实验也证实,这种药安全性和耐受性良好。罗氏希望借助独特心血管代谢特征,aleglitazar可以在与武田Actos和GSK Avandia等同类药的竞争中抢得先机。
aleglitazar的 III期临床实验于2010年启动,共有7000多名患有2型糖尿病和心脏疾病的患者参与,主要是观察新近突发过心脏病的患者使用该药后,能否降低心血管疾病风险的几率。实际结果表明,该药在部分患者当中造成了肾脏和心脏衰竭。罗氏表示,这款旨在降低血糖和坏胆固醇的药物并未向最初希望的那样有效。
罗氏全球产品开发负责人哈尔-巴伦(Hal Barron)在一份声明中表示:“我们对这一结果深感失望。我们原本希望aleglitazar能够为面临心血管疾病风险的2型或晚期糖尿病患者带来巨大的好处。”
这是罗氏在药物研发上遭受的又一次重大挫折。2010年,由于一些患者用药后出现超敏反应,该公司决定停止糖尿病药物taspoglutide的研发。去年5月,该公司又宣布因为临床效果不佳停止降胆固醇药物达塞曲匹(dalcetrapib)的研发,导致其股价大跌。
在aleglitazar的研发暂停之前,分析师们估计该药的潜在销售额可能达到20亿至40亿瑞士法郎(21亿至41亿美元)。而现在,罗氏可能不得不重新评估其糖尿病资产组合。
罗氏首席发言人亚历山大-克劳泽(Alexander Klauser)表示,该公司“将评估其在代谢性疾病领域的资产组合和研发努力”,并补充称,该公司仍将致力于拓展抗癌药以外的业务。
此次挫败还有可能影响到监管机构对葛兰素史克(GSK)生产的类似药物Avandia的决定。由于可能增加心脏病发的风险,该药在美国已被限制使用,而欧洲监管机构已于2010年禁止该药出售。
不过,葛兰素史克一直坚称Avandia是安全的,而美国政府的一个专家小组上月也呼吁放宽对该药的限制。
PPAR药物研发存在巨大风险 开发需谨慎
PPAR 是一类由配体激活的核转录因子,属于Ⅱ型核激素受体超家族,包括由不同基因编码的3种亚型(PPAR-α、PPAR-δ和PPAR-γ),能调节摄入脂肪的储存和代谢。研究发现,PPAR-δ与PPAR-γ是抗糖尿病药物作用的靶点,PPAR-α是降血脂药物的作用靶点。随着糖尿病形成机理研究的不断深入,在PPAR激动剂研发领域中,PPAR-δ激动剂与PPAR双重或三重激动剂成为近年来开发的热点。罗氏此次试验的终止是所谓的PPAR双激动剂药物研发遭受的最新挫败。这为PPAR药物的开发前景抹上了一层阴影。
此次罗氏停止PPAR药物的开发并不是个例,在罗氏之前,英国制药巨头阿斯利康(AZN)与百时美施贵宝(BMY)也已停止了此类药物的研发。罗氏坚持研发也曾被分析师认为是一个风险很大的赌博。
PPAR 激动剂的研发确实存在巨大的风险,因为有肾毒性或致癌的副作用,有许多在研的PPAR激动剂药物被迫做更多的临床研究或终止研发。诺和诺德(Novo Nordisk)公司在临床前研究中发现PPARα/γ双激动剂 Ragaglitazar(NN622/DRF2725,DrReddy'Laboratories授让得到)与肿瘤(鼠的尿路膀胱肿瘤)有关,暂停了 Ragaglitazar的III期临床研究。默克和日本杏林制药在动物长期毒性实验中发现,在研的PPARα/γ双激动剂MK-767可引起一种罕见的恶性肿瘤,因此公司终止了此药的Ⅲ期临床试验。
阿斯利康公司(AstraZeneca)的tesaglitazar(Galida),在美国糖尿病协会(ADA)第65届科学年会上公布的Ⅱ期临床研究数据显示,该药的耐受性良好(不良反应取决于用药剂量),且对2型糖尿病患者的血糖控制呈剂量依存性,同时本品还具改善类脂异常作用。该药于2003年10月进入Ⅲ期临床研究。2006年阿斯利康制药公司停止了其双通道PPAR激动剂 Galida(Tesaglitazar)的开发。阿斯利康制药公司称,涉及2245名病人的Ⅲ期临床试验数据没有证明该药和现有的2型糖尿病治疗药物相比有显著的优越性,特别是比较了其风险-利益评估结果。在临床试验中发现它会使血清肌酐上升,而肾小球滤过率下降。尽管这些副作用都是可逆性的,停药后即自行消失,和肾毒性也没有关联。但值得注意的是,以前的4个Ⅲ期临床试验(GALLANT6、7、8、9)和一个Ⅱ期临床试验(ARMOR)都出现了相同的问题。
以前被寄予很大期望的双通道PPAR激动剂都先后因为安全性问题被叫停,如2001年葛兰素史克制药公司的 Rarglitazar ;2003年底默克制药公司的MK-767,被FDA要求补充数据;2005年日本武田制药公司的TAK-559;2003年初诺和诺德制药公司的 Ragalitazar(原开发企业是印度瑞迪制药公司); 2005年百事美施贵宝制药公司退出和默克制药公司联合开发双通道的PPAR激动剂,原因也是FDA要求提供更多关于安全性的临床试验数据。
从这些药物的临床试验结果看,它们的治疗窗和安全窗十分接近,可能不适宜继续开发双通道的化合物。而单通道激动剂,如贝脂类化合物(PPARα激动剂)及噻唑烷二酮类(PPARγ激动剂)已经上市,并取得比较好的疗效。
Galida 曾经被分析认为如果在2008年上市,2012年的销售就可达到4.27亿美元。仍处于开发中的此类化合物仍然有不少,甚至有三通道的PPAR激动剂被研究出来。其中,礼来和Ligand公司共同开发的Naveglitazar、三井制药公司和Perlegen科学公司共同开发的 Netoglitazone α-δ-γ三通道PPAR激动剂,以及罗氏制药公司的PPARα激动剂K-ill都是在Ⅱ期临床试验阶段就结束了。