PROTEOMICS:O-GalNAc糖基化修饰蛋白质的系统发现
近日,上海交通大学系统生物医学研究院张延课题组在国际知名蛋白质组学研究期刊PROTEOMICS上发表题为《Systematic identification of the protein substrates of UDP-GalNAc: polypeptide N-acetylgalactosaminyltransferase-T1/T2/T3 using a human proteome microarray》的文章。该研究运用点击化学反应与蛋白质芯片技术相结合、实现了快速高通量发现O-GalNAc糖基转移酶(ppGalNAc-T)修饰蛋白质底物的新方法(on-chip ppGalNAc-T assay)。为系统性研究O-GalNAc糖基化修饰的调控机制提供了一种新手段。
蛋白质糖基化,是蛋白质的一种重要翻译后修饰,参与了各种重要生命活动。其中黏蛋白型O-糖基化修饰(Mucin-type O-glycosylation,也称为O-GalNAc糖基化修饰)在个体发育、肿瘤发生、细胞粘附等诸多生命活动中均发挥非常重要的作用,但是由于缺乏共有修饰序列信息和有效的O-糖基化分析技术手段,长期以来生物体有哪些蛋白会发生O-GalNAc糖基化修饰知之甚少,极大地限制了人们对蛋白质O-糖基化调控在生理和病理过程中的认知。
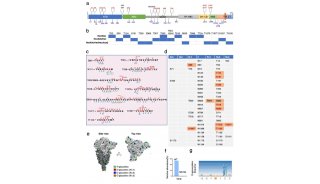
张延课题组一贯致力于蛋白质的O-GalNAc糖基化调控的基础研究,在这项研究中与陶生策课题组精诚合作,在蛋白质芯片上对三种主要的ppGalNAc-T酶进行了检测,共得到近600种O-GalNAc糖基化修饰候补底物蛋白,发现胞内蛋白可发生O-GalNAc糖基化修饰,发现酶的底物选择性与酶的拓扑进化一致。
这项研究为高通量发现O-GalNAc糖基化修饰蛋白,解析糖基转移酶与糖基化蛋白质在生命体内的时空性关系提供了有效的研究手段和重要的数据基础。
该研究得到国家973项目、国家863项目、国家自然科学基金项目等项目的支持,张延课题组博士生许之珏同学为论文第一作者,陶生策研究员为共同通讯作者。