重磅综述 | 如何完善微生物组与疾病之间的证据链?从相关性到因果关系的5个层次
重磅综述 | 如何完善微生物组与疾病之间的证据链?从相关性到因果关系的5个层次

● 期刊:Nature Chemical Biology
● 影响因子:15.040
● 发表时间:2021.09.22
摘要
与人类相关的微生物在人类健康中发挥着至关重要的作用,微生物失衡已与各种疾病状态联系在一起。在这篇综述中,作者探讨了从鉴定与人类疾病相关的微生物的相关研究进展到建立微生物产物和宿主表型之间的因果关系的实验,通常遵循一系列证据,这些证据来自:
(1) 微生物组与疾病表型的关联研究;
(2) 无菌动物、抗生素处理过的动物或人的表型变化;
(3) 粪便微生物群移植(FMT)转移供体表型;
(4) 产生疾病表型的菌株的鉴定;
(5) 识别引起疾病表型的微生物分子(如代谢物等)。
利用这个“漏斗”实验作为研究的指南,作者探索了微生物群是如何导致代谢紊乱与高血压、感染和神经系统疾病的。此外,还讨论了使用FMT和微生物激发疗法治疗人类疾病的潜力,以及这些方法的局限性。
前言
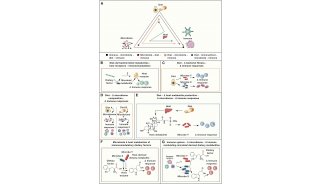
人类微生物群与健康和疾病有关,但直到最近,人们对与人类相关的微生物是如何驱动宿主表型的了解相对较少。人类微生物组领域的许多早期工作都是相关的,识别与健康个体或疾病患者相关的微生物。最近的研究,在某些情况下以这些相关研究提出的假设为指导,已经开始在微生物群和疾病之间建立菌株和分子水平的联系。这些对于了解微生物群如何影响人类健康和开发治疗疾病的新疗法是必要的。然而,随着大量研究的出现,确定一个给定的报告如何有助于微生物群落因果影响特定的宿主表型的首要证据是具有挑战性的。在这里,作者概述了一个总体战略,以评估微生物组与人类疾病的证据链。作者建议研究可以在五个层次上进行分析,从关联研究到分子机制研究(图1)。
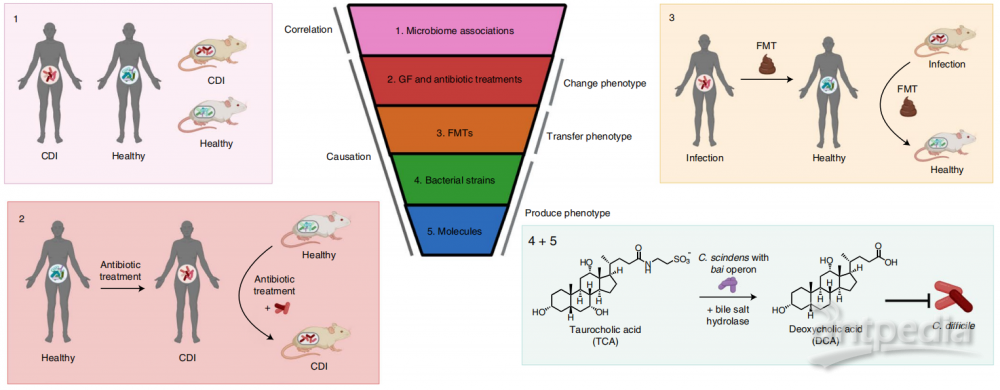
图1.人类微生物研究中从相关性到因果关系的证据链。将微生物群与特定人类疾病联系起来的证据可以作为一个五层漏斗进行评估。以共生细菌对抗CDI(艰难梭菌感染)作为一个例子。首先,人类数据中的相关性表明,与健康个体相比,疾病个体的微生物群落发生了改变。抗生素诱导的生态失调使患者罹患CDI的风险增加。第二,与未经治疗或常规对照组相比,接受抗生素治疗的人类或GF小鼠(无菌小鼠)显示出改变的疾病表型。用克林霉素等抗生素治疗常规小鼠,然后再用艰难梭菌刺激导致CDI。第三,FMT将表型从供体转移到受体。从健康个体到复发性CDI患者的FMT可解决90%的病例感染。第四和第五,特定的微生物及其产生的分子,分别在体内产生一种表型。共生细菌C. scindens及其邻近的基因具有诱导胆汁酸操纵子(bai),该操纵子编码的酶能使第7位的初级胆汁酸(如胆酸)脱羟基,产生次级胆汁酸(如脱氧胆酸),抑制艰难梭菌的生长。
Level 1:观察到微生物和疾病表型之间的关联。
利用测序技术能够确定哪些微生物在患病个体和健康个体中普遍或特殊存在(表1)。这些相关研究促进了进一步的因果调查。
Level 2:抗生素治疗的人或小鼠以及无菌小鼠显示改变的表型。对微生物群落耗竭生物体的表型分析研究表明,微生物在某些疾病的病理生理学中发挥因果作用,但不知道具体是哪些微生物。虽然无菌(GF)动物和抗生素治疗都是研究微生物参与宿主表型的有效方法,但这些方法有各自的优缺点,进一步的机制研究需要用动物和人开展实验,来阐明微生物对宿主表型的影响。
Level 3:粪菌移植转移表型。FMT(粪菌移植)涉及将供体的粪便物质转移到受体动物或人身上以确定转移宿主微生物组是否也会引起表型变化。就像微生物群落衰竭一样(Level 2),FMTs揭示了因果关系,而不是分子机制。
Level 4:鉴定产生表型的微生物菌株。讨论哪些微生物产生了疾病相关的表型,并且微生物生化库的信息如何帮助阐明驱动疾病的分子机制。
Level 5:明确产生表型的微生物分子。鉴定微生物产生的分子并进行功能预测,有助于进一步加深对微生物组如何调节宿主生理和改善疾病策略的理解(表2)。
表1:微生物组与宿主表型间的相关性
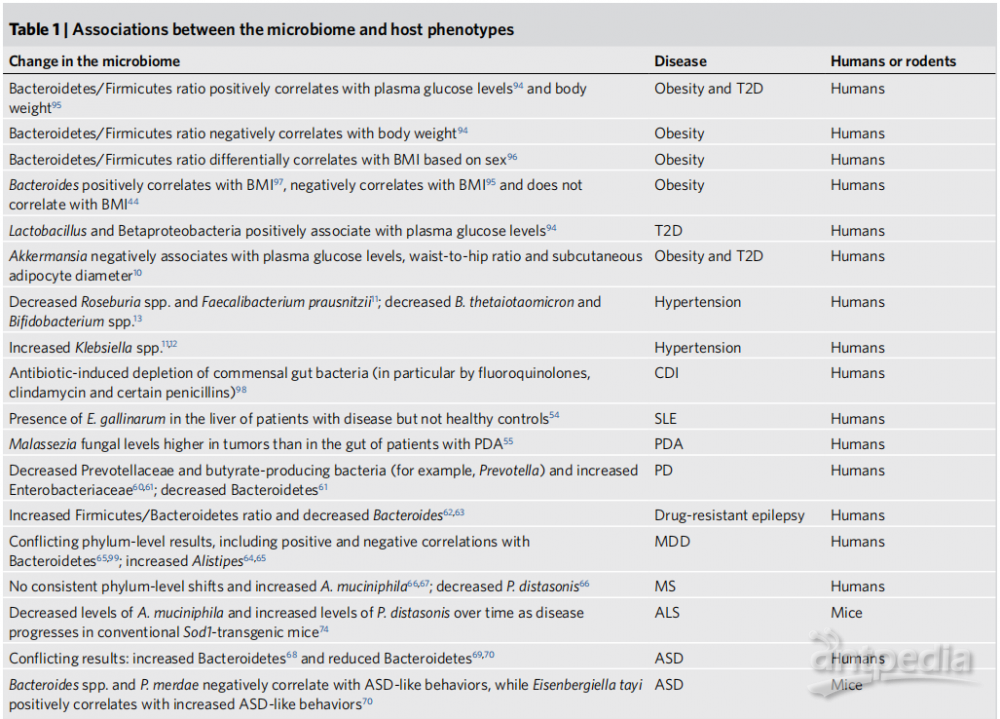
表2:微生物组与宿主表型间的因果联系
接下来,作者以应用该五层漏斗策略评估与微生物组因果相关的三个领域的研究:代谢紊乱与高血压、感染和神经系统疾病。本次解读重点介绍代谢性疾病和高血压。
代谢性疾病和高血压
肥胖和2型糖尿病(T2D)是孪生流行病。超过90%的糖尿病患者体重超标,而且糖尿病患者经常伴有高血压等合并症。在这里,作者讨论在啮齿动物模型和人类患者中一致观察到的微生物-宿主相互作用。细菌代谢产物如胆汁酸(BAs)和短链脂肪酸(SCFAs)影响体内代谢和高血压表型,但其组织特异性和机制有待进一步研究。
Level 1:在代谢性疾病患者中观察到的最常见的微生物群落相关特征是微生物多样性减少。然而,不同年龄、性别、人口统计学特征或地理位置的患者,菌群在门水平的变化存在差异(表1)。高血压患者的微生物群落的Alpha多样性低于健康对照组。在属水平上,条件致病菌克雷伯氏菌在高血压患者中的含量明显高于健康人。有趣的是,研究报告了产生SCFA的拟杆菌(Bacteroides thetaiotaomicron)、双歧杆菌(bifidobacteria)、Roseburia和Faecalibacterium prausnitzii11的丰度下降,这增加了细菌产生SCFA可能影响高血压的病理生理的可能性。
Level 2:对GF小鼠或抗生素治疗动物和人类的研究产生了复杂的、有时相互矛盾的结果,这强调了基于菌株和分子的研究的必要性。在人类中,使用抗生素治疗青少年和儿童与肥胖的发展有关。这种联系是独立于抗生素谱观察到的,并且是剂量依赖的。相比之下,在成人中,某些抗生素治疗可导致体重减轻,胰岛素敏感性提高,炎症和肠道通透性改善。这种抗生素作用的差异可能源于儿童肠道菌群衰竭的有害影响。需要进一步研究年龄、抗生素谱和剂量依赖效应,以确定抗生素如何影响人类肥胖。
啮齿类动物研究的结果也有细微差别。GF动物在高脂肪饮食中对体重增加有抵抗力,这表明微生物在发育过程中增强了致肥表型。然而,抗生素治疗会导致幼畜和成年动物的体重增加。尽管这些结果很复杂,但一个普遍的发现似乎是微生物的消耗对幼小动物和人类的新陈代谢健康是有害的。这些结果为研究生命早期微生物群的因果关系提供了动力。
虽然微生物组衰竭对高血压的影响还有待研究,但现有数据表明,微生物组衰竭可改善高血压。用抗生素去除微生物群可解决大鼠皮质酮引起的高血压,而消耗SU5416/缺氧大鼠的肠道微生物群可抑制肺动脉高压的发生。同样,口服二甲胺四环素和万古霉素可降低达尔盐敏感(S)和自发性高血压(SHR)大鼠的血压。这些研究表明,微生物群在高血压的发展中起着重要作用。
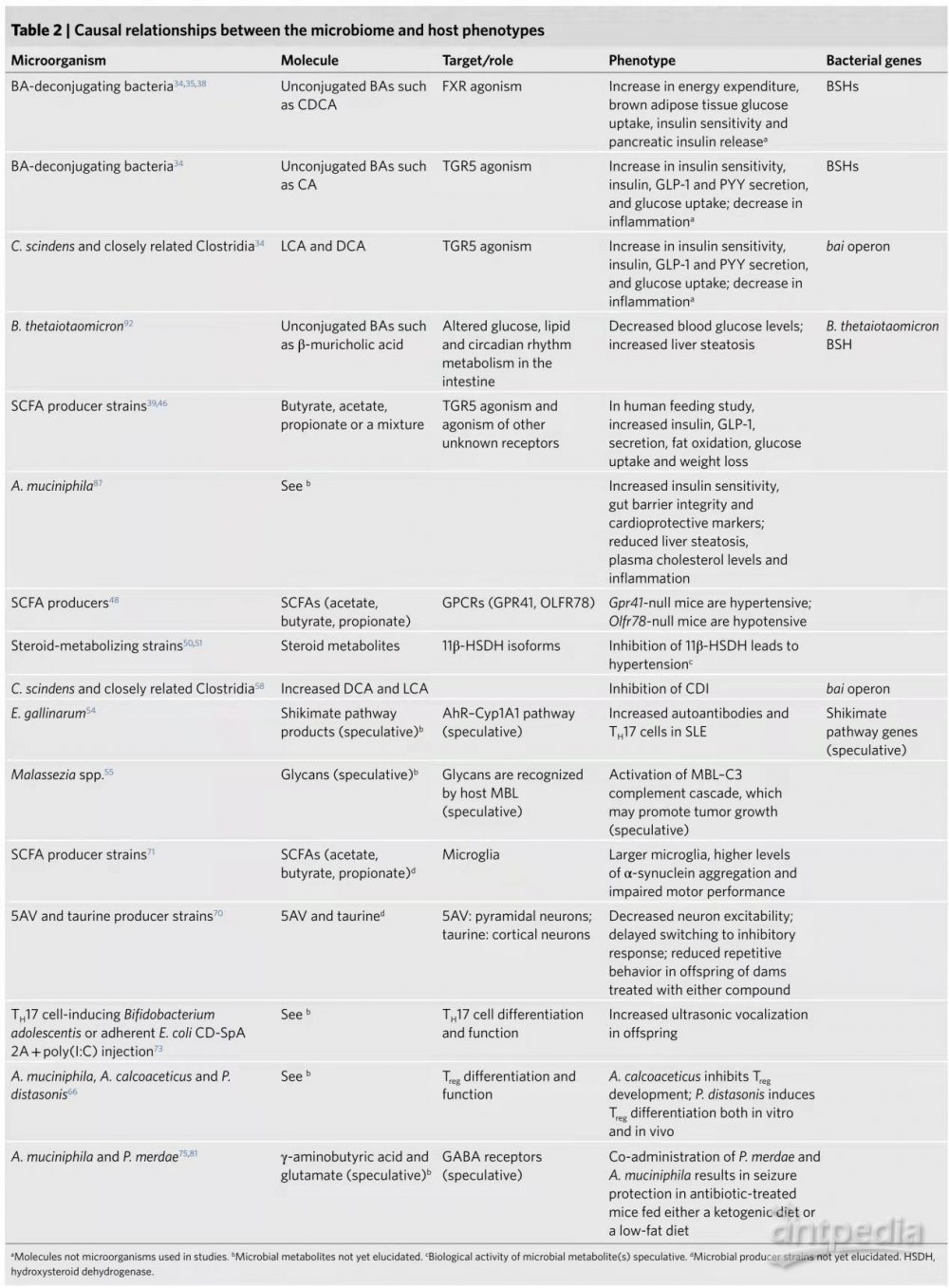
Level 3:把来自体重不同的人类双胞胎的粪菌移植到GF小鼠,导致受体小鼠的代谢曲线与人类供体小鼠的代谢曲线相一致(图2a)。此后,FMTs在啮齿动物模型中显示,肠道微生物可以转移热量限制、运动、减肥手术、改善体重管理和抗糖尿病药物疗效等有益表型(图2b)。此外,FMT还减少了胰腺组织中低度炎症标志物的水平,直接改善了胰岛素抵抗。这些研究表明,微生物在调节代谢表型中发挥了因果作用。
图2. FMTs转移代谢紊乱表型并影响代谢状态。a,来自肥胖人类或小鼠的FMT将疾病相关的表型转移到受体小鼠。特别是,GF受体表现出葡萄糖摄取降低、胰岛素敏感性和肠道屏障完整性降低、肝脏脂肪变性增加、血压升高和体重增加。b,来自瘦小鼠或人类供体的FMT可以改善小鼠或人类受体的某些代谢表型。人类和小鼠的受体都表现出葡萄糖摄取增加、胰岛素敏感性和肠道屏障完整性增强。FMT在两组中均未重复显示能诱导体重减轻。
尽管在改善糖尿病方面取得了一些效果,但人类FMT似乎并未改善致肥表型(图2b)。此外,FMT研究仅记录了改善高血糖和胰岛素敏感性的短期效应(6-8周),且与体重相关的表型没有变化。这些结果似乎主要是由于供体的微生物无法长期在受体中定植,需要进一步研究FMT剂量和移植方式的优化,以评估其作为治疗代谢综合征的治疗策略的可行性。
高血压表型似乎是通过FMT转移的。将来自高血压阻塞性睡眠呼吸暂停(OSA)大鼠的盲肠内容物移植到正常血压大鼠体内后,受体大鼠的血压升高。同样,SHR大鼠(自发性高血压大鼠)的盲肠内容物在抗生素处理的WKY大鼠(正常血压大鼠)中诱导高血压。最后,从人类高血压供体到GF小鼠的FMT增加了受体小鼠的血压。
Level 4+5 :因果研究已经证明了微生物衍生分子在肥胖和T2D表型中的作用。BAs(胆汁酸)是一组由宿主合成、细菌修饰的代谢产物,影响宿主的代谢。在肝脏中产生结合的初级BAs,如牛磺酸和肝胆酸(TCA和GCA)和牛磺酸和肝胆去氧胆酸(TCDCA和GCDCA)。多种肠道细菌通过胆汁盐水解酶(BSH)水解结合型BAs,而一小部分细菌将胆酸(CA)和鹅去氧胆酸(CDCA)转化为次级BAs,如脱氧胆酸(DCA)和石胆酸(LCA)(图3a)。使用经细菌修饰的BAs可以改善人类的糖尿病表型。例如,喂食CDCA(图3a) 2天增加了患者的全身能量消耗和棕色脂肪组织的葡萄糖摄取。同样,用牛磺酸去氧胆酸(TUDCA)治疗4周可增加肥胖个体的胰岛素敏感性。在人类中,TUDCA是一种偶联的次级BA,由肠道细菌将CDCA向UDCA单聚,然后将UDCA与肝脏中的牛磺酸偶联而产生。单个BA分子通过G蛋白偶联受体(GPCR) TGR5(或GPBAR1)和胆汁酸受体(FXR,或NR1H4)影响代谢信号。然而,BA信号是复杂的,组织和受体特异性效应可能影响代谢表型。
另一种可以改善肥胖和T2D表型的细菌产物是SCFAs。丰富的短链脂肪酸丁酸、乙酸和丙酸是微生物代谢碳水化合物的产物(图3b)。给肥胖患者口服或直肠使用SCFAs可降低血糖水平,增加胰岛素和胰高血糖素样肽1 (GLP-1)水平。重要的是,与抗糖尿病和抗肥胖作用相关的细菌,如嗜黏蛋白-艾克曼克菌、小肠罗氏杆菌和长双歧杆菌是肠道中的主要发酵菌,它们可以降解膳食纤维和黏蛋白以产生SCFAs。FMTs会导致患者血浆中短链脂肪酸水平的升高,以及短链脂肪酸生产者的丰富度的增加,如罗氏弧菌和假长双歧杆菌。这表明细菌产生SCFAs有助于FMT介导的代谢表型的改善。
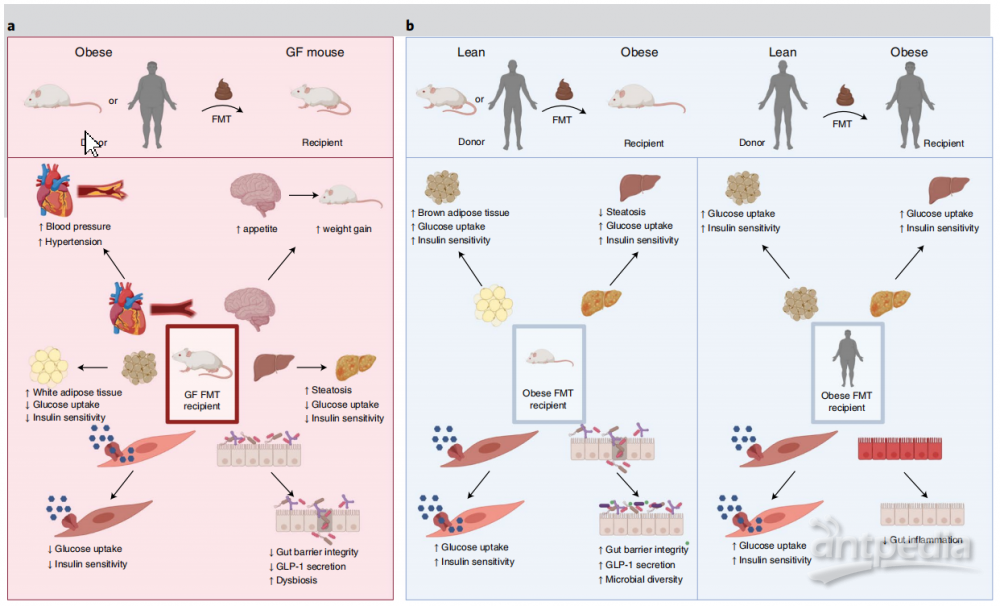
图3 .微生物代谢物类似物作为疾病疗法的研究进展。a,肠道细菌BSHs将宿主产生的结合BAs ,如TCDCA和GCDCA转化为CDCA, TCA和GCA转化为CA。CDCA是一种改善体内代谢综合征表型的FXR激动剂。INT-747是CDCA的一种合成衍生物,其效力是CDCA的2 - 5倍,目前正在进行2期临床试验。INT-747治疗可改善啮齿动物模型和人类患者的糖尿病、体重增加和肝纤维化。INT-777是CA的衍生物,CA是一种弱TGR5激动剂,效力高十倍以上。INT-777改善啮齿动物的代谢疾病表型,包括糖尿病、肥胖、动脉粥样硬化和炎症。b,短链脂肪酸是由肠道细菌降解膳食碳水化合物、纤维和肠道粘蛋白产生的。在由微生物群产生的短链脂肪酸中,丁酸显示出作为一种治疗代谢性疾病的治疗方法的潜力。单甘油三酯、二甘油三酯或三甘油三酯治疗可改善啮齿类动物的高血糖、炎症、肥胖和肝脏脂肪变性。
但有点矛盾的是,肥胖患者粪便中短链脂肪酸的含量高于瘦人对照组。在肥胖个体中,循环SCFAs与胰岛素敏感性、脂肪分解和血浆GLP-1水平有关,这表明从肠道吸收到体循环的SCFAs可能参与改善代谢表型。此外,有证据表明,SCFAs在脂肪组织、骨骼肌和肝脏中的作用有助于改善身体质量指数(BMI)和胰岛素敏感性。SCFAs通过结肠细胞顶端和基底外侧的特殊转运体从肠道被动吸收进入体循环。需要进一步研究SCFAs转运体的活性和表达,以了解微生物群和SCFAs在改善代谢性疾病表型中的作用。
一些证据初步表明,肠道微生物代谢物可以影响血压。SCFAs可能通过GPCR信号通路,GPR41和嗅觉受体78 (OLFR78)诱导高血压,但需要进行体内研究来证实这一假设。此外,肠道失调过程中产生的促炎细胞因子和氧化应激可能导致低密度脂蛋白(LDL)的氧化。氧化后的LDL反过来会降低一氧化氮水平,增加内皮素-1水平,从而导致高血压。肠道细菌可以产生皮质类固醇代谢产物,其结构与已知的11β-羟类固醇脱氢酶(11β-HSD)抑制剂相似,可导致人类高血压。然而,在体内抑制11β-HSD并诱发高血压的特定细菌和细菌代谢产物尚未被发现。大量证据支持微生物组影响宿主代谢和相关疾病的结论,进一步研究确定涉及的菌株和分子将促进新的治疗策略的发展,以对抗代谢综合征和高血压。此外,需要更好地理解微生物代谢产物的组织特异性效应,进而提升利用微生物组靶向治疗的临床效果。
病原体和感染
肠道微生物群落能够抵御病原体的侵染和定植。抗生素治疗会破坏菌群结构,增加病原体入侵的易感性。肠道微生物抵抗病原体(如肠球菌和肠杆菌科)感染的分子机制已有过综述报道。在这里,作者关注的是病原体从肠道异位到其他组织从而加重疾病的过程。此处,以讨论微生物抑制艰难梭状感染(CDI)作为因果漏斗实验的一个经典案例。
Level 1:众所周知,在抗生素治疗后,难辨梭状芽胞杆菌可引起肠道感染。最近的研究是开始探索微生物从肠道转移到周围组织是否可能导致疾病。例如,在一项针对系统性红斑狼疮(SLE)患者的小型研究中,患者的肝脏含有鸡肠球菌(一种肠道病原体)的DNA。此外,马拉色菌属真菌在肿瘤中的水平高于在胰腺导管腺癌(PDA)患者的肠道。需要进一步研究更大的人类群体来确定这些相关性是否可重现。
Level 2:肠道微生物群的抗生素消耗,首先增加了局部感染的风险,然后是进一步全身感染的风险。用万古霉素或氨苄青霉素(而非新霉素)治疗小鼠SLE(系统性红斑狼疮)模型,可抑制肠系膜淋巴结(MLNs)和肝脏中的细菌生长并降低死亡率,这表明革兰氏阳性病原体可能与疾病有关。同样,两性霉素B治疗对PDA(胰腺导管腺癌)缓慢和快速进展的小鼠模型的胰腺肿瘤生长均有保护作用,而这一保护作用在GF小鼠中未观察到,表明真菌微生物群落参与了小鼠PDA的进展。
Level 3:FMT(粪菌移植)是治疗人类复发性CDI(艰难梭菌感染)的有效方法,有效率高达90%(图1)。目前尚不清楚FMT如何影响病原体的易位。对患者的研究发现,FMT可以抵御抗生素耐药性的细菌感染,因此,FMT有望可以用于靶向病原驱动的疾病。然而,FMT并不是治疗感染的万能药。在肠出血性大肠杆菌(EHEC)小鼠模型中,从易感小鼠到耐药小鼠的FMTs导致鼠类柠檬酸杆菌感染增加。这些结果强调了并非所有FMT都有益于疾病治疗。
Level 4+5:在感染小鼠模型中使用抗生素,使研究者能够确定影响传染性的细菌菌株和分子。在抗生素治疗的小鼠和接受干细胞移植的患者中,产生次级胆汁酸的梭状芽孢杆菌的存在与感染耐药性相关。将C. scindens施用于抗生素治疗的小鼠,然后感染C. difficile可改善CDI并恢复 DCA 水平,这表明补充产次级胆汁酸细菌可能有助于FMTs在啮齿类动物模型中对CDI的有效性(图1)。
肠道微生物易位对疾病的分子机制影响尚未完全阐明。在野生型小鼠中,鸡肠球菌(E.gallinarum)能够诱导自身抗体和辅助性T细胞17 (TH17),而其他易位细菌如粪肠球菌(Enterococcus faecalis)则不能。提示鸡肠球菌可通过激活芳香烃受体(AhR) -细胞色素P450家族1亚家族A成员1 (CYP1A1)通路诱导TH17细胞。虽然鸡肠球菌含有莽草酸酯途径编码的基因和来自该途径的分子已知是AhR配体,但尚未检测鸡肠球菌是否能产生莽草酸酯来源的小分子。在PDA进展的情况下,马拉色菌种而非其他真菌,加速了PDA肿瘤在小鼠的生长。马拉色菌需要甘露糖结合凝集素(MBL) -C3补体级联来促进体内肿瘤生长。由于MBL与聚糖结合,有人提出真菌细胞壁聚糖触发了胰腺肿瘤的进展。然而,这些聚糖的特性或它们对MBL的可用性可能必须与非促肿瘤真菌产生的聚糖不同。未来的工作可能揭示鸡肠球菌和马拉色菌是否分别通过AhR配体和聚糖或其他小分子来发挥它们的作用。更广泛地说,无菌的器官或基本上没有微生物的器官在疾病期间是否有微生物定植是未来研究方向,可能揭示疾病发展的新机制,从而启发新的治疗方法。
肠脑轴和神经系统性疾病
越来越多的证据表明,微生物群对神经系统疾病的发病有因果影响。在某些情况下,细菌因子可能提供环境“打击”,当与宿主介导的因子结合时,导致疾病的发生或发展。在其他情况下,细菌可能提供有益的因素,用遗传成分改善疾病。在少数病例中,细菌代谢物可能在没有基因改变的情况下调节神经功能。需要进一步的研究来建立或验证分子机制,并将在小鼠中观察到的影响与人类疾病联系起来。在这里,作者将重点关注微生物组在帕金森病(PD)、肌萎缩性脊髓侧索硬化症(ALS)、多发性硬化症(MS)、癫痫和癫痫发作、抑郁和焦虑以及自闭症谱系障碍(ASD)中的作用。
Level 1:与对照组相比,神经系统疾病患者的微生物群落往往发生变化。然而,仅在部分疾病中观察到一致的变化。例如,与健康个体相比,PD患者(尤其是普雷沃菌科)和耐药癫痫患者(尤其是拟杆菌)的肠道菌群中拟杆菌门的丰度降低。相反,抑郁症患者的Alistipes比健康个体丰度增加。此外,与健康对照或健康的同卵双胞胎相比,多发性硬化症患者中嗜粘蛋白-阿克曼氏菌的丰度增加。这些结果表明这些细菌产生的代谢产物有参与神经调节分子的潜力。
关于ALS和ASD患者的微生物组成是否改变以及如何改变,有一些相互矛盾的证据。例如,在一些研究中拟杆菌门种类与ASD呈正相关,而在另一些研究中则与ASD呈负相关。这些结果说明人类微生物组的持续变化给研究带来挑战,并揭示明确神经疾病的特征微生物组概况存在很大的困难。
Level 2:最近,使用抗生素治疗或无菌(GF)小鼠,在理解肠-脑轴方面取得了显著进展。在某些情况下,微生物组的消耗导致疾病表型的改善。值得注意的是,GF小鼠具有永久性神经发育缺陷,这可能会影响在这些动物身上进行的神经学研究的结果。在一个α-突触核蛋白(ASO)过表达的PD小鼠模型中,GF和抗生素治疗的动物在运动功能测试中都表现出改善的表现,减少便秘,降低大脑中α-突触核蛋白聚集和小胶质细胞激活。同样,患有实验性自身免疫性脑脊髓炎(EAE)的GF小鼠(MS小鼠模型)也没有发病。最后,用多聚(I:C)免疫刺激治疗传统怀孕小鼠会导致后代大脑和行为异常,而用万古霉素治疗怀孕小鼠可以防止这些异常。尽管在把小鼠和人类的行为等同起来是需要谨慎,但特异性无病原体(SPF)后代的行为与ASD患者表现出的行为相似,这表明微生物群可能在儿童ASD的发展中具有因果作用。
相比之下,微生物组耗竭会导致ALS小鼠模型的疾病恶化。与野生型同窝小鼠相比,抗生素治疗的ALS小鼠表现出更多的运动异常,脊髓细胞死亡,脑萎缩和神经退行性变化,GF小鼠表现出更高的死亡率。同样,生酮饮食的抗癫痫作用在GF和抗生素治疗的小鼠中也消失了,这表明微生物群对这种饮食给予的保护是必要的。最后,与SPF小鼠相比,经过抗生素治疗的成年小鼠和GF野生型小鼠表现出了恐惧消退学习能力受损,即“忘记”恐惧反应的能力。一旦威胁被消除就无法改变自己的行为,这与人类的神经精神障碍有关,包括创伤后应激障碍(PTSD)。微生物群落作为一个整体与对神经发育和功能的有益和有害影响相关,这一发现加强了该领域开展机制研究的必要性。
Level 3:早期使用FMTs治疗人类神经系统疾病的研究显示了一定的可行性,在小鼠模型中使用FMTs进一步支持了微生物和表型之间的因果关系。在PD病例中,与微生物组缺失可改善运动异常的发现一致,与对照移植ASO小鼠相比,人类PD患者的FMT植入GF ASO小鼠可导致运动功能受损(图4a)。在移植了帕金森病微生物群的野生型动物中没有发现运动差异,这表明对帕金森病的遗传易感性可能是微生物群受损影响疾病进展的必要条件。
同样的,与健康的双胞胎相比,遗传易感小鼠与MS患者的微生物群一起移植时发生EAE的频率更高,与对照组相比,与MS患者的微生物群移植时疾病评分更差。此外,ASD患者的FMTs转化为野生型GF小鼠会导致这些受体小鼠繁殖的成年后代出现行为缺陷,包括重复行为增加,运动和交流减少(图4a)。
虽然数量不多,但临床研究发现,从健康个体到MS和ASD患者的FMT可以改善疾病(图4b)。在一项案例研究中,一名多发性硬化症患者接受FMT治疗后,症状得到了长期改善,如便秘减少,神经和运动功能得到改善,包括恢复行走能力。然而,FMT后未进行测序分析,因此尚不清楚供体微生物组是否被植入。在另一项研究中,ASD患者在接受抗生素治疗后,每天服用FMT剂量,持续7-8周,在研究期间,胃肠道(GI)和行为症状均有改善。
与微生物消耗加重癫痫发作和恐惧消退学习障碍的发现相一致,FMT对GF小鼠的作用可预防或改善这些情况(图4b)。有趣的是,当一名同时患有克罗恩病和癫痫的人类患者接受FMT治疗时,尽管停止了抗癫痫药物治疗,她在接下来的20个月里没有出现癫痫发作。这些研究初步表明,FMT可以在某些情况下用于治疗人类癫痫。同样,出生后定植的GF小鼠在恐惧消退学习方面表现出与SPF小鼠相当的能力,而断奶后定植的GF小鼠在恐惧消退学习方面表现出受损。这些结果表明,幼鼠在关键发育期接受关键微生物信号刺激对其行为发育是很有必要的。
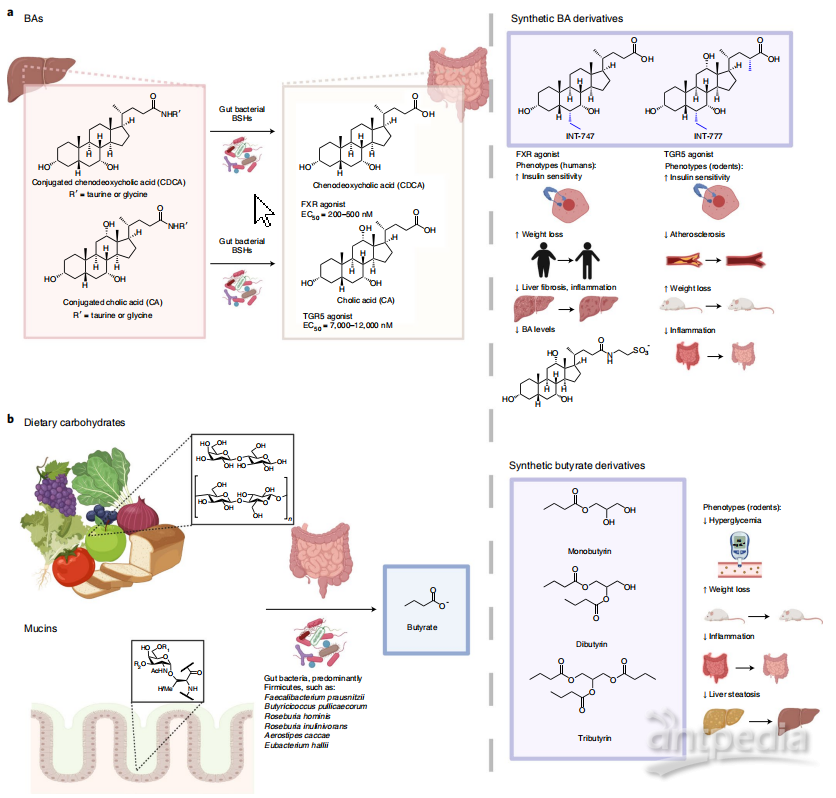
图4 . FMTs转移神经表型并影响神经性能。a,来自患有神经障碍的人类供体的FMT将疾病相关的表型转移到受体小鼠。具体来说,PD患者FMT转化为GF α-突触核蛋白过表达小鼠导致运动功能受损和便秘增加,MS患者FMT转化为EAE的GF小鼠导致疾病表型恶化,如麻痹和神经元脱髓鞘。和FMT从ASD患者到GF小鼠导致这些动物后代的行为异常。b,来自健康人类供体的FMT改善小鼠或人类受体的神经异常。当用生酮喂养的传统小鼠的FMT治疗时,出生后的小鼠表现出对癫痫发作的保护增强,而用传统小鼠的FMT治疗时,表现出对恐惧消除学习的增强。在个别案例研究中,来自健康捐供体的FMTt也减少了癫痫发作,增加了神经、运动和胃肠道功能,并改善了癫痫、多发性硬化症和自闭症患者的行为和胃肠道症状。
Level 4+5:在识别调节肠-脑相互作用的菌株和分子方面已经取得了早期的进展。PD的情况下,在之前发现SCFAs调节小胶质细胞激活的基础上,研究人员对GF ASO小鼠进行了用SCFAs处理的化学互补实验。与未处理的小鼠相比,经SCFA处理的小鼠显示出更大的小胶质细胞,更高水平的α-突触核蛋白聚集和受损的运动性能。然而,PD中的细菌转移与SCFAs水平变化之间的关系尚不清楚。
自闭症谱系障碍、细菌和代谢物之间的关系也很难确定。在一项研究中,代谢组学显示,与健康对照组相比,ASD患者和移植有ASD菌群的GF小鼠后代中弱GABAA (γ-氨基丁酸亚型A)受体激动剂5-氨基戊酸(5AV)和牛磺酸的水平降低。肠道细菌可通过半胱氨酸的代谢或牛磺酸偶联的BAs水解产生牛磺酸(图3a),脯氨酸经细菌发酵产生5AV。在ASD小鼠模型中,怀孕小鼠和新生小鼠使用5AV或牛磺酸进行化学互补实验发现可减少幼鼠的重复行为。在使用神经元的实验基础上,提出这些代谢物调节神经元功能,帮助平衡大脑中的兴奋性和抑制性信号。需要在动物中进一步研究5AV和牛磺酸生产菌和非生产菌定植的机制。在另一项研究中,怀孕小鼠的后代都被TH17细胞诱导的人类肠道细菌菌株所感染,并接受多聚(I:C)注射,表现出增加的ASD样表型,包括增加的重复行为和减少的社会互动。这些结果表明,细菌对母鼠TH17细胞的刺激会导致子代行为异常。虽然尚未确定涉及的特定细菌因子,但BA代谢物是潜在的候选者,因为LCA(石胆酸)衍生物已被证明会影响TH17细胞功能。
在MS的情况下,研究表明,与健康个体相比,在MS微生物群定植的GF小鼠中,产生白介素(IL)-10的调节性T细胞 (Treg)水平降低。MS患者钙乙酰不动杆菌水平升高,Treg发育受到抑制,而对乙酰类副杆菌水平降低,并诱导Treg分化。尽管有人提出类似于宿主产生的髓磷脂的细菌蛋白可以诱导自身免疫,但引起这些宿主免疫反应的细菌因子仍不清楚。
相比之下,抗生素治疗的ALS小鼠的肌张力失调使疾病症状恶化,而给药AKK菌(嗜黏蛋白艾克曼氏菌)可改善运动功能,增加脊髓细胞数量,延长寿命。代谢组学鉴定出两种代谢物,烟酰胺和苯酚硫酸盐,与ALS微生物组相比,它们很可能是由野生型合成的。烟酰胺可能是由肠道细菌通过色氨酸降解而产生的。与烟酰胺的化学互补改善了行为和运动测试的表现。
副杆菌属和嗜黏蛋白-艾克曼克菌也与改善小鼠癫痫发作有因果关系。二者联合给药可对抗生素治疗的小鼠产生癫痫保护作用。海马和结肠的神经递质GABA和谷氨酸水平在这些小鼠中增加。拟杆菌属、拟杆菌属和大肠杆菌已被证明能产生GABA81。值得注意的是,人类的重度抑郁症(MDD)与GABA缺陷有关。因此,肠道细菌产生的GABA有可能改善癫痫发作和抑郁行为,还需要进一步的研究来验证这一假设。
由于神经系统疾病与微生物相互作用的复杂性,阐明微生物影响肠-脑轴的机制可能是开发有效疗法的关键。例如,P. distasonis在 MS 小鼠模型中发挥有益作用而在ALS小鼠模型中发挥有害作用,这就突出需要在分子水平上理解宿主-微生物相互作用,以便将这些发现转化为疾病治疗的策略。
科研延伸
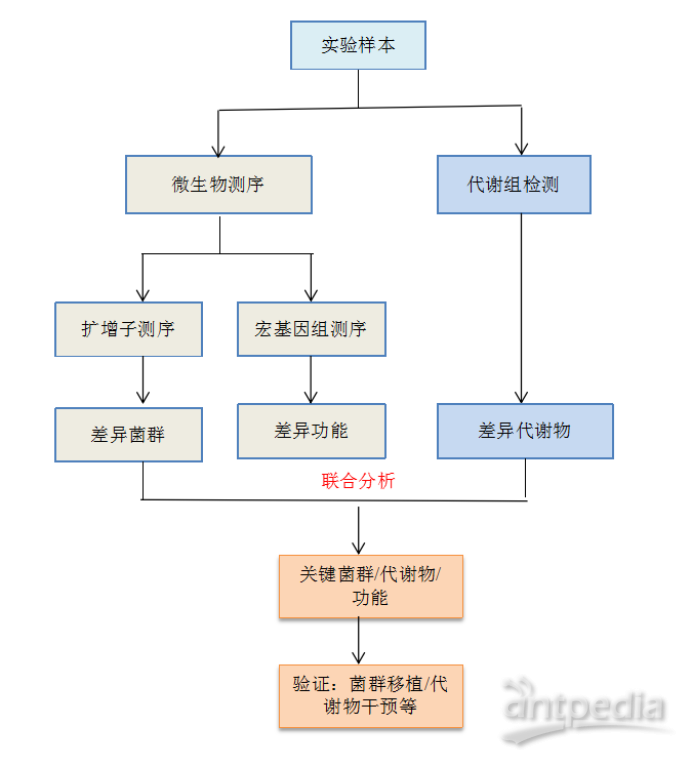
迈维代谢经过多年经验积累,已总结出一套菌群代谢的完善的研究策略,可以通过16S扩增子与宏基因组测序得到差异菌群和差异功能;采用广筛代谢组学方法(如非靶向代谢组、广泛靶向代谢组、TM广靶代谢组、广泛靶向脂质组、全谱代谢组等)或靶向检测功能性的代谢物得到微生物代谢物以及宿主内源代谢物的变化,将差异菌群及功能和代谢物进行联合分析,挖掘关键菌群和功能以及代谢物,进一步在采用粪菌移植或者代谢物干预实验进行因果分子机制探索,该研究思路已经在在宿主生理、疾病病理、药物药理等方面取得众多重要进展,具有广泛的应用前景。
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章







