研究蛋白质动态构象变化的新方法
2月28日,Angewandte Chemie International Edition在线发表了中科院生物物理研究所王江云研究组、龚为民研究组及中国科技大学田长麟研究组合作题为A Genetically Encoded 19F NMR Sensor for Tyrosine Phosphorylation的最新研究成果。该研究通过基因密码子扩展,实现在原核及真核酪氨酸激酶活性中心编码氟代酪氨酸,利用19F核磁(NMR)研究酪氨酸激酶活性中心的构象变化,这为基于酪氨酸激酶活性中心构象进行抗肿瘤药物的筛选提供了有力的工具。
酪氨酸磷酸化是一种重要的蛋白质翻译后修饰,其在酶活性、蛋白质构象及蛋白-蛋白相互作用的调节过程中发挥着极其关键的作用。酪氨酸激酶活性中心的酪氨酸异常磷酸化是导致许多疾病发生的主要原因,尤其与肿瘤的发生关系密切。目前,针对酪氨酸激酶活性中心设计的抑制剂已经成为肿瘤治疗的主要手段。但是随着酪氨酸激酶上的药物作用位点的突变,越来越多的患者对现有的抗肿瘤药物产生了耐药性。因此,发展快捷灵敏的检测酪氨酸激酶活性中心构象的方法对设计新的抗肿瘤药物具有十分重要的意义。
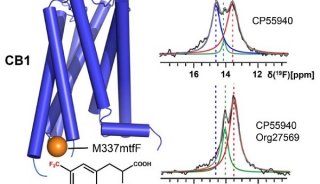
该研究通过基因密码子扩展的手段实现了氟代酪氨酸在原核酪氨酸激酶Etk活性中心Tyr574位点的高效特异插入,以此作为19F NMR的磷酸化探针并首次获得Etk活性中心的pTyr574与Arg614之间相互作用而导致Etk激活的直接证据。另外,研究人员将氟代酪氨酸插入到真核酪氨酸激酶c-Src活性中心的Tyr416磷酸化位点,利用19F NMR检测到dasatinib(针对BCR/Abl和c-Src的抗肿瘤药物)与c-Src激活状态活性中心的结合所引起的构象变化。这为研究酪氨酸激酶的激活机制以及基于酪氨酸激酶与底物相互作用进行抗肿瘤药物的筛选提供了重要的手段。
本论文的第一作者为助理研究员李发慧,博士研究生石攀、李家松为共同第一作者。该研究得到科技部国家重点基础研究973计划、国家自然科学基金委和中国科学院的资助。