首个治疗疾病根源的药物Oxbryta(voxelotor)获美国FDA批准!
Global Blood Therapeutics(GBT)公司近日,美国食品和药物管理局(FDA)已加速批准Oxbryta(voxelotor),用于12岁及以上镰状细胞病(SCD)儿童和成人患者的治疗。Oxbryta是一种每日口服一次的药物,是首个被批准直接抑制镰状血红蛋白聚合的治疗药物,这是SCD的根本病因。Oxbryta有望在两周内通过GBT的专业药房合作伙伴网络上市销售。Oxbryta通过FDA的优先审查通道获得批准,从新药申请(NDA)被受理到最终批准仅仅用了2个多月时间。

Oxbryta的活性药物成为voxelotor(前称GBT440),通过增加血红蛋白对氧的亲和力发挥作用。由于氧合的镰刀血红蛋白不聚合,voxelotor能阻断聚合化及由此导致的红细胞镰状化和破坏。voxelotor可改善溶血性贫血和氧运输,并潜在地改变SCD的进程。
此前,FDA已授予voxelotor治疗SCD的突破性药物资格、快速通道地位、孤儿药资格和罕见儿科疾病资格。在欧洲,EMA已授予voxelotor优先药物资格(PRIME)以及治疗SCD的孤儿药资格。除了在≥12岁SCD患者中开展的III期临床研究HOPE之外,GBT公司目前也正在开展一项IIa期研究HOPE-KIDS 1,这是一项开放标签、单剂量和多剂量研究,评估voxelotor治疗SCD儿科患者(4-17岁)的安全性、耐受性、药代动力学、探索性疗效。
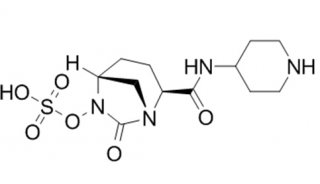
voxelotor分子结构式(图片来源:drugapprovalsint.com)
GBT总裁兼首席执行官Ted W.Love表示:“今天的批准不仅是GBT的一个重要里程碑,对于SCD患者及其家人以及那些关心他们的人来说更是一个重要的里程碑。8年前,我们开始与SCD社区合作,着手改变这种毁灭性的终身疾病的治疗方式。我们很自豪能将这种突破性药物带到SCD社区。”
Oxbryta获得FDA批准,基于III期临床研究HOPE的结果,相关数据已发表于《新英格兰医学杂志》(NEJM)。HOPE是一项随机、双盲、安慰剂对照研究,在全球22个国家60家研究机构开展,评估了2种剂量水平的voxelotor(1500mg和900mg,每日一次口服给药)与安慰剂治疗SCD的疗效和安全性。研究共入组了274例年龄在12岁及以上SCD患者,大部分患者患有镰状细胞贫血(纯合子血红蛋白S或血红蛋白Sβ0-地中海贫血),基线时约三分之二在接受羟基脲治疗。研究中,患者以1:1:1的比例随机分组,分别接受1500mg voxelotor、900mg voxelotor或安慰剂每日一次口服治疗。主要终点是在意向性治疗分析中,实现血红蛋白应答的患者比例,血红蛋白应答定义为第24周的血红蛋白相对基线增加超过1.0g/L。
结果显示,与安慰剂相比,voxelotor显著增加了血红蛋白水平、降低了溶血生物标志物。这些结果与抑制HbS聚合相符,voxelotor表现出改善疾病的潜力。
具体数据为:在意向治疗分析中,1500mg voxelotor治疗组(51%,95CI:41-61)产生血红蛋白应答的患者比例显著高于安慰剂组(7%,95%CI:1-12)。从基线至第24周,voxelotor各剂量组发生贫血恶化的患者数量均少于安慰剂组。此外,第24周时,1500mg voxelotor治疗组间接胆红素水平和网织红细胞百分比相对于基线的降幅显著超过安慰剂组。
治疗期间,各试验组发生不良事件或不良事件恶化的患者百分比相似。1500mg voxelotor治疗组有26%的患者、900mg voxelotor治疗组有23%的患者、安慰剂组有26%的患者发生了≥3级不良事件。大多数不良事件经研究调查员确定与试验药物或安慰剂无关。
业界对Oxbryta的商业前景十分看好,医药市场调研机构EvaluatePharma今年6月发布报告预测,Oxbryta将成为全球最畅销的SCD药物,2024年销售额预计将达到19.8亿美元,来自蓝鸟生物的基因疗法Zynteglo/LentiGlobin在同期的销售额将达到10.33亿美元。
Zynteglo/LentiGlobin是一种一次性基因疗法,开发用于SCD和β地中海贫血的治疗。该药通过慢病毒载体将表达正常血红蛋白β亚基的基因(βA-T87Q-珠蛋白基因)在体外植入到从患者体内取出的造血干细胞中,再将这些细胞回输入患者体内。
今年6月,Zynteglo获欧盟有条件批准,用于12岁及以上、非β0/β0基因型的输血依赖性β地中海贫血(TDT)患者。此次批准,使Zynteglo成为全球治疗TDT的首个基因疗法。但行业人士认为,该药更大的市场机会存在于SCD治疗领域。