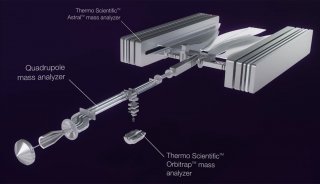
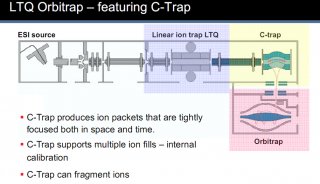
HILIC-MS VS IP-RPLC-MS:在DNA引物小核酸和mRNA加帽率分析应用
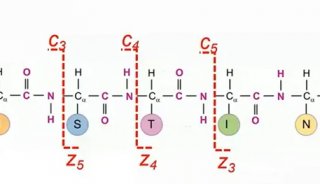
核酸是蛋白之外,生物制品领域另一重要分支。近年来,核酸药物引起了公众和研究单位极大的兴趣。本文就DNA核酸引物、小 核酸和mRNA加帽的色谱质谱方法进行讨论。 DNA引物是PCR测序的起始原料,其质量的优劣对PCR测定结果的影响较大。色谱法可实现DNA引物纯度的初步评价,但无法分 离极性或结构类似的杂质,也无法对分子量进行确证。部分对引物质量控制较为重视的单位在本世纪初逐渐引入低分辨质谱,用 于引物分子量的确证。但低分辨质谱无法实现纯度分析和序列准确分析。因此,超高分辨质谱(如Orbitrap)逐渐进入高端客户 的实验室,用于进一步提高DNA引物的质量评价。 相对于DNA引物,小核酸药物对色谱、质谱分析方法的开发具有更大的需求。如果将小核酸与多肽药物类比,两者具有相似之 处,同时具有显著差异。相似之处在于,两种药物均要求进行严格的杂质控制、分子量测定和序列表征。小核酸药物和多肽药物 中均具有大量结构相似和极性相近的杂质,对色谱分离造成极大的挑战。不同之处在于,相比多肽药物,小核酸的碱基数目更少 (4类碱基),需要获得特异性更大的小核酸需要更长的序列或更独特的修饰。由于特异性碎片更少,质谱确认杂质种类和结构 时,对一级的质量精确度和分辨率要求更高。此外,质谱分析中,核酸的二级断裂方式比多肽药物更多、丰度更低,对质谱的灵 敏度、二级质量准确度和软件的自动匹配功能要求更高。 加帽率和加尾的分布是mRNA疫苗的关键质量属性,影响疫苗的实际翻译效率和稳定性。常规检测方法无法区分mRNA的各种加 帽和未加帽形式。MS,尤其是基于Orbitrap技术的高分辨率、高选择性和高灵敏度MS是解决该问题的唯一途径。 受基质效应的影响,为了提高质谱检测结果的准确性,尤其是定量结果的准确性,减少共同流出组分的干扰,需要适当的色谱分 离。相对于蛋白、多肽和大部分小分子化合物,核酸具有极性大、电负性强的特点,难以被常规反相作用色谱保留。挥发性离子 对-反相作用色谱(IP-RPLC)可增加核酸的保留,同时兼容MS的负离子检测。但核酸分析的离子对试剂通常是极易电离的有机 胺类物质,该类物质在色谱和质谱系统中容易残留,从而导致MS的正离子模式灵敏度降低甚至难以检测。因此,使用IP-RPLC分 析核酸后的LC-MS系统需要经过彻底清洗,才可用于正离子模式的分析(多肽、蛋白和大部分小分子药物)。长期使用IP-RPLC 分析核酸的LC-MS系统,即使彻底清洗仍难以恢复正离子模式原有的检测灵敏度,因此该类实验通常建议“专机专用”。寻找 IP-RPLC替代的分析方法,解决核酸的保留和质谱兼容性问题,一直受到研究者的关注,尤其是多肽药物、蛋白药物、小分子药 物和核酸药物均有涉及的实验室。由于核酸具有高极性,部分研究者尝试使用亲水作用色谱(HILIC)分析核酸类物质。本文对比 了HILIC-MS和IP-RPLC-MS在小核酸、DNA探针和mRNA加帽分析中的应用,为读者提供一些思路。
HILIC-MS与IP-RPLC-MS分析小核酸
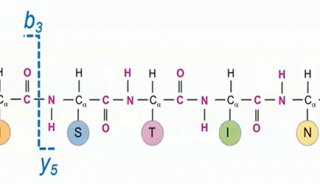
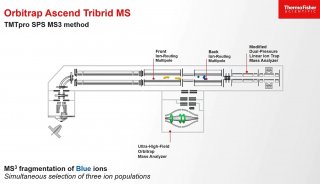
相比IP-RPLC,HILIC在该小核酸的片段分析(fragmentation)中表现出更好的分离选择性。在HILIC分析中,比主峰 更短的片段(fragments)均都在主峰前面出峰且呈现出较好的分离度。更好的分离度有助于提高含量较低组分在质谱中的响 应,增加该组分被鉴定的几率。如表5所示,在HILIC-MS分析中,共鉴定到23个小核酸片段。由于Orbitrap的高灵敏度,即使 含量最低的片段1,仍能获得较好的2级覆盖,增加其鉴定的可靠性。同时由于Orbitrap的高灵敏度和HCD碎裂对大的 二级碎片的获取能力,即使长度高达23碱基的长片段杂质也可获得丰富的二级碎片,实现序列全覆盖并提供可靠的序列鉴定 结果。
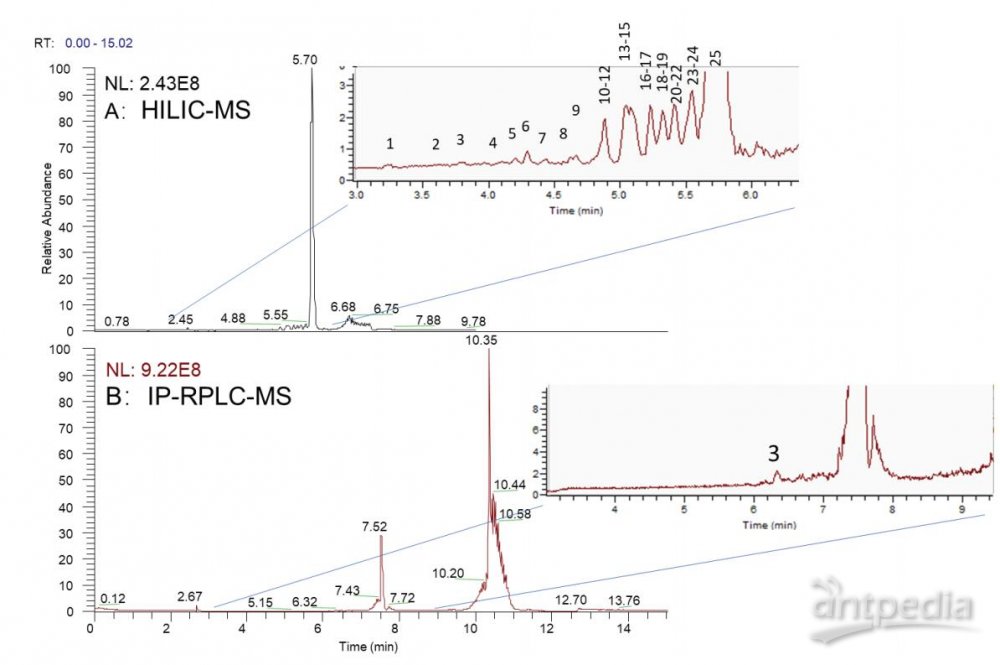
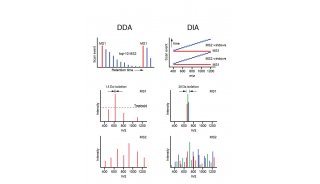
图1 HILIC-MS和IP-RPLC-MS分析小核酸的TIC图
HILIC-MS与IP-RPLC-MS分析DNA探针
IP-RPLC和HILIC均可为目标探针提供较好的峰形和良好的质谱响应。由于Orbitrap的高灵敏度和HCD碎裂对不同长 度二级碎片的兼容性,两种DNA探针均可实现全序列覆盖。
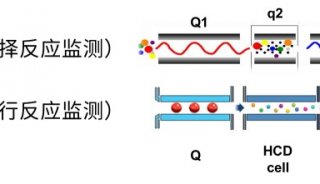
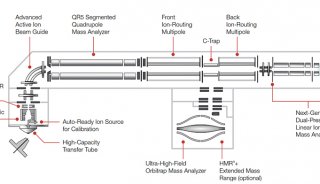
Orbitrap出色的能力不仅体现在定性分析。由于Orbitrap在拥有高分辨率的同时,还能提供高灵敏度、宽线性范围和高的质量 稳定性,Orbitrap还是出色的定量分析检测器。我们用Orbitrap的PRM定量模式对DNA探针1进行定量分析,在上样量低至5 pmol时仍然具有较高的响应和良好的线性,该灵敏度远超Q-TOF分析。
HILIC-MS与IP-RPLC-MS分析mRNA加帽样品
无论是一步法加帽还是两步法加帽处理的样品,在IP-RPLC-MS模式中,探针和mRNA5’端均可实现良好的分 离。因此,加帽样品的检测不受高浓度残留探针的影响。在HILIC-MS模式中,由于探针和5’端样品极性均较大且极性相似, 洗脱该组分所用流动相比例已接近HILIC色谱模式最低点[2]。无法通过优化梯度实现加帽样品中的探针和mRNA5’端的分离。 受探针信号的抑制,部分在IP-RPLC-MS模式中可检出的组分,在HILIC-MS模式无法去卷积得到。
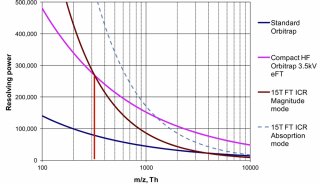
结论 综上所述,IP-RPLC-MS和HILIC-MS模式均可实现DNA探针和小核酸药物的检测。在一些小核酸和DNA探针的检测中,HILICMS具有更好的分离选择性、良好的灵敏度和线性。在mRNA加帽样品的检测中,仍然推荐IP-RPLC-MS分离检测。DNA探针、 小核酸和mRNA的分离检测对质谱要求较高,需要精确的一级质量数、丰富的二级碎片、高分辨率(7万以上)用于排除假阳 性和对定量及定性结果的干扰。因此,无论是IP-RPLC模式还是HILIC模式分离,均推荐Orbitrap作为质量分析器,从而保障结 果的可靠性。