默沙东HIV药物doravirine非劣效于Efavirenz
7月25日,美国默克制药公司(美国及加拿大外称为默沙东)公布了第二个评价doravirine治疗HIV-1感染的有效性及安全性的关键性临床3期试验DRIVE-AHEAD的试验结果,其中doravirine属于非核苷类逆转录酶抑制剂(NNRTI)。在48周的该项试验显示,相较于依法韦仑(EFV,Efavirenz)、恩曲他滨(FTC)及富马酸替诺福韦二吡呋酯(TDF)固定剂量复方,基于HIV-1 RNA的水平低于50 拷贝/mL 患者的比例,对于初治HIV-1感染患者,一天一次的含有doravirine(DOR)、拉米夫定(3TC)和富马酸替诺福韦二吡呋酯(TDF)的固定剂量复方片剂达到了主要的非劣效性疗效终点。
另外,48周的时间里,相较于服用EFV/FTC/TDF的患者,服用了DOR/3TC/TDF的患者出现预先设定的神经精神系统疾病事件(头晕、睡眠紊乱及失调、思维不清或思维不集中)的统计学比例明显更低。同时,服用DOR/3TC/TDF的患者,空腹低密度脂蛋白(LDL-C)和非高密度脂蛋白相较基线时水平,改变明显更小。正在进行中的3期DRIVE-AHEAD研究结果会在法国巴黎举行的2017年HIV科学国际大会((IAS 2017)中进行口头陈述。
美国费城托马斯杰斐逊大学感染疾病学科教授及主任,临床试验的研究者Kathleen Squires博士表示:“与含efavirenz复方相比,48周的DRIVE-AHEAD研究的数据证明,含有doravirine的固定剂量复方达到了对HIV-1感染初治患者病毒的成功抑制,这一研究结果令人鼓舞,因为doravirine这一药物可以为患者提供一种新的单一片剂治疗选择。”
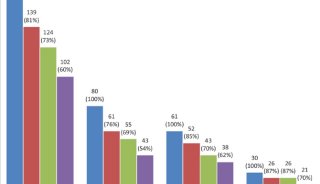
经过48周的治疗后,服用一天一次DOR/3TC/TDF的364名初治患者中,84%的人群的HIV-1 RNA<50 拷贝/mL;364名服用EFV/FTC/TDF的患者组,HIV-1 RNA <50 188="" 198="" tdf="" hiv-1="" rna="">100,000 拷贝/mL)的患者同样观察到了治疗效果,这一类型患者在DOR/3TC/TDF组和EFV/FTC/TDF组的人数分别为69人和73人,DOR/3TC/TDF组中81%的这类患者达到了HIV-1 RNA<50 拷贝/mL 这一主要疗效终点,EFV/FTC/TDF组这一数据也为81%,治疗差异为1%(95%置信区间;-12.4, 14.3)。
该项研究同样达到了安全性终点:相较于EFV/FTC/TDF组,DOR/3TC/TDF治疗组的48周精神神经系统疾病事件发生率更低,其中头晕(8.8% vs 37.1%)、睡眠紊乱及失调(12.1% vs 25.5%)、思维不清及不集中(4.4% vs 8.2%),这三项指标的治疗差异2-sided p-值分别为 p<0.001, p<0.001以及p=0.033。
这项研究中,DOR/3TC/TDF用药组的所报道的和药物相关的不良事件发生率更低(31%,113/364); EFV/FTC/TDF组为63%,229/364(-31.9%治疗差异)(95% 置信区间, -38.6, -24.8)。因为不良事件导致的研究中止率分别为DOR/3TC/TDF(3%,11/364)、 EFV/FTC/TDF(7%,24/364)。
DOR/3TC/TDF用药组及EFV/FTC/TDF中发生率≥10%的最常见的不良事件包括头痛(13% vs 12%)、腹泻(11% vs 14%)、鼻咽炎(11% vs 9%)、头晕(9% vs 37%)、恶心(8% vs 11%)、异常做梦(5% vs 12%)以及皮疹(5% vs 12%)。
48周中,治疗中出现的由于病毒突变导致的治疗耐药的发生率分别为1.6(DOR/3TC/TDF)、3.3%(EFV/FTC/TDF)。
两个用药组,空腹脂质水平(低密度脂蛋白LDL-C和非高密度脂蛋白non-HDL-C)在研究分析中同样显示了具有统计学意义的显着治疗差异(p<0.0001)。相比基线水平,DOR/3TC/TDF 组的空腹LDL-C和non-HDL-C 的平均改变分别为-1.6 mg/dL 、-3.8 mg/dL;EFV/FTC/TDF组则分别为 +8.7 mg/dL 、+13.3 mg/dL。
默沙东临床研究助理副总裁George Hanna博士表示:“默沙东公司致力于HIV感染治疗的药物研发工作已经有30年,其中doravirine 属于公司的十年研发成果,基于已经获得的备受鼓舞的临床3期研究数据,我们计划在2017年第四季度提交该药物的注册申请。”