酞菁铁(Ⅱ)的制备及表征
武汉大学化学与分子科学学院
王小尚 200331050033
摘要:
通过制备Fe(OH)2·4H2O制备酞菁铁(Ⅱ), 并对产品进行纯化,通过紫外及红外的方法分析确定其组成[微软用户1]
关键字:酞菁铁(Ⅱ);制备;纯化;红外;紫外分光法[微软用户2]
1.前言
酞菁类化合物可以看成四氮杂卟啉的衍生物,具有D2h点群对称性。其在染料工业和光电功能材料等方面获得了巨大的应用,并具有电致变色效应,在室温下有很好的液晶相,也在催化剂,抗辐射剂等方面也有重要作用。
酞菁类化合物的合成一般采用Linstead合成方法,其提纯比较困难。反应产物中含有大量的杂质,包括原料和一些其他高分子聚合物,常用的提纯方法有微热丙酮索氏萃取除杂,真空升华,浓H2SO4再沉淀或色谱柱提纯。
合成酞菁铁的前体有:邻苯二甲酸,邻苯二甲酸酐,邻苯二甲氰,邻苯二甲酸氨酯等。
本实验以邻苯二甲酸酐,Fe(OH)2·4H2O(自制),尿素为原料,以(NH4)2MoO4为催化剂,采用固相熔融法合成FePc,用真空升华法提纯产物,纯产物经元素分析,红外及紫外可见光谱表征。
2.实验部分
2.1试剂及仪器:
1. 试剂[微软用户3]
还原铁粉,6mol/L[微软用户4] 盐酸,邻苯二甲酸酐,尿素,乙醇,10%氢氧化钠,酸铵,浓硫酸
2. 仪器
减压过滤装置,旋转蒸发仪,真空干燥器,量筒(50mL),三口瓶(250mL,100mL),滤纸,烧杯(250mL),24#圆底烧瓶(100mL),24#空气冷凝管,24#磨口弯头,24#磨口塞,油泵,19#导气管,橡皮管,电热套(250mL), 研钵,温度计(3000C),长玻棒,容量瓶(50mL)表面皿,牛角勺,天平,氮气钢瓶,管式电炉,旋子流量计,石英管,烘箱,小瓷舟,UV-Vis分光光度计,红外光谱仪[微软用户5] 。
2.2实验步骤:
1. FeCl2·4H2O的制备
称取5.67g还原铁粉放入100 mL的三口烧瓶中,并向其中加入30 mL6mol/L的盐酸溶液,缓缓通入氮气至液面下,烧瓶上的一个瓶口用导气管将逸出气体(包括反应的生的H2和为了防止氧化而通入的N2以及少量HCl气体)通经过安全瓶(防倒吸)导入稀碱溶液(中和逸出的少量HCl气体)。适当控制通气量,大约每秒钟两个气泡。
当反应进行大约两个半小时后,反应瓶中H2产生的速度减慢时,迅速减压过滤得到氯化亚铁浅绿色溶液。过滤时可向减压漏斗上方通N2,减少Fe2+的氧化。将滤液迅速转入已用氮气冲洗过的100mL24#圆底烧瓶中,旋转蒸发出现大量浅绿色结晶。将三口瓶取出,冷却,放入冰水浴中待其结晶,但要使晶体能够倒出(留少量液体),迅速抽滤,立即转移至表面皿中(动作快,防止氧化),置于真空干燥器中抽真空充氮气数次,放置使其干燥。产品呈浅绿色晶体,表面有少许因氧化呈黄色。一周后称重3.3582g。
将第一步反应剩余铁粉抽滤干燥称重得2.82g,所以反应了的铁粉重:5.67─2.82=2.85g。
2.酞菁铁的合成
称取5g邻苯二甲酸酐,7g尿素,0.1g钼酸铵,置于研钵中研细并混合均匀后,称取1.3122g自制FeCl2·4H2O置于研钵中研细并混合均匀,小心加入到干燥的250mL24#三口烧瓶中。三口烧瓶中间接一空气冷凝管,一个侧口通入氮气,温度计从另一侧口直接插入反应物中。用电热套加热,三口瓶与电热套不直接接触,略留空隙,防止局部过热。为了减少邻苯二甲酸酐的升华以及尿素的分解,先在80~100OC反应一小时,再将温度缓缓上升至200OC。随着加热过程的进行,混合固体逐渐熔融,呈现深棕色。在2000C左右恒温反应2h。其间不时将凝聚在烧瓶和冷凝管上的邻苯二甲酸等用长玻璃棒小心刮下来使其回到烧瓶底部。反应结束后,冷却至室温,加入25mL4mol/L的盐酸,搅动并转移至研钵中,研磨后转移到250mL的烧杯中煮沸,减压抽滤,滤液为深黄色,产物呈黑色颗粒。将固体转移到250mL烧杯中加入25mL 10%的NaOH溶液浸泡,搅拌均匀。再次抽滤压干。经NaOH溶液浸泡后产物颗粒变得细腻。再用25mL4mol/L盐酸煮沸一次,抽滤后用10~20mL乙醇洗两次。抽干得到黑色固体粉末粗产品。在1000C烘箱中烘干,放入真空干燥器中保存,一星期后称得3.2559g。
3. 酞菁铁的升华提纯
将制得的样品放入小瓷舟中,再将小瓷舟放入长玻璃管中,一并放入管式电炉中,小瓷舟的位置在靠近氮气进口处1/4的处。抽真空并维持真空压强在133Pa,氮气保持微小流量,将电炉加热到5500C左右,恒温2h,停止加热。关掉真空泵,稍冷后将玻璃管取出使其更易冷却,氮气继续通。自然冷却到室温后关掉氮气,取出产品,产品为蓝紫色针状晶体。
4.样品的表征
(1)紫外可见光谱的测定
以浓H2SO4为溶剂,用毛细管取少量样品入比色皿中,控制好浓度,溶液呈现淡紫色,太浓谱图不能出峰;设定测定条件如下:扫描范围200~1000nm,ABS:0~2.0,所得数据、谱图如下:
波长(nm) | 200 | 210 | 263 | 293 | 372 | 415 |
ABS | 0.856 | 1.139 | 0.625 | 1.275 | 0.308 | 0.373 |
波长(nm) | 482 | 625 | 775 | 800 | 900 | 1000 |
ABS | 0.275 | 0.161 | 1.512 | 0.186 | 0.122 | 0.102 |
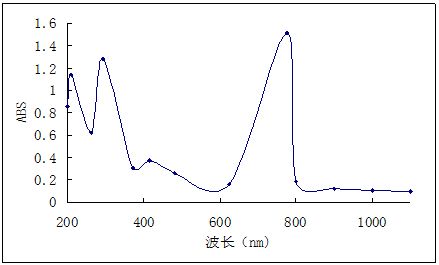
谱图分析:有一个最大尖峰在约780nm左右,三个小矮峰在200-400nm之间。
(2)红外光谱测定
谱图如下:
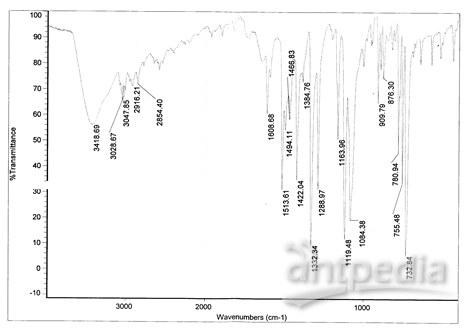
谱图分析:
以3418.69 cm-1 为中心的谱带是N-H的伸缩振动峰, 1100~33750px-1范围内出现的C-N键的伸缩振动峰;3047.85,3028.67 cm-1为苯环的C-H伸缩振动和苯环骨架振动的倍频带的共同贡献,此外1450~40000px-1范围里还出现了苯环的骨架伸缩振动峰,650~22500px-1范围内出现了芳环C-H面外弯曲振动峰; 22744.75px-1处有一中强振动峰,是酞菁谱图中不存在的,可以判断它是与为铁有关的特征吸收峰。综上分析可初步推断酞菁铁已合成。
3.实验结果及讨论
1.产率计算:
制备FeCl2时反应为:Fe +2HCl = FeCl2 + H2(g)
理论产量为:6.46g 实际产量:3.36[微软用户6] g 产率:52.0%
由1.3gFeCl2·4H2O制备酞菁铁(M=567.85)的理论产量为:3.75g 实际产量:2.86g
产率:76.3 %
2.Fe2+在空气中有水存在的情况下极易氧化,所以在整个反应过程中以及保存时都应注意氮气的保护和保持样品干燥。转移的动作要快,尽量减少其在空气中留的时间。
3.注意旋转蒸发器的使用:将烧瓶连接好后抽真空,设置水浴温度并加热,开启冷凝水,旋转蒸发。注意控制温度,使有气泡产生但不暴沸。
4. 酞菁铁的合成:酞菁铁的合成时各种反应物的充分接触很重要,要注意搅拌。由于反应中邻苯二甲酸容易凝聚在烧瓶和冷凝管上,而且不易用长玻璃棒刮下来使其回到烧瓶底部,故可适量补加一些纯的反应物。
5. 酞菁铁的升华提纯:升华前应该检查体系的气密性,通过抽真空,真空度稳定可知体系密封性好
参考文献:
[1]沈永嘉主编 酞菁铁的合成与应用.北京:化学工业出版社,2000
[2] M Hanak,et al. Coord Chem Rev,1988(83):115
[3]张良辅等,合成化学,1997(5):26
[4] [日]土田英俊等编,方世壁等译.高分子络合物的电子功能.北京:北京大学出版社,1993
[5] O Schneider,et al. Angew Chem,1980(92):391
[6] R P Linstead,et al.J Chem Soc,1934.1022~1033
[7] Haruhiko Jomada,et al. Chem Lett,1983.313
[8]C F Van Nostrum,et al.Inorg Chem,1996(35):959~969
[9]王静秋等编.无机化学专业实验.1997
[10]大学化学实验改革课题组编.大学化学新实验.兰州:兰州大学出版社,1993
[11]武汉大学化学系无机化学教研室编.无机化学实验(第二版).武汉:武汉大学出版社,1997











