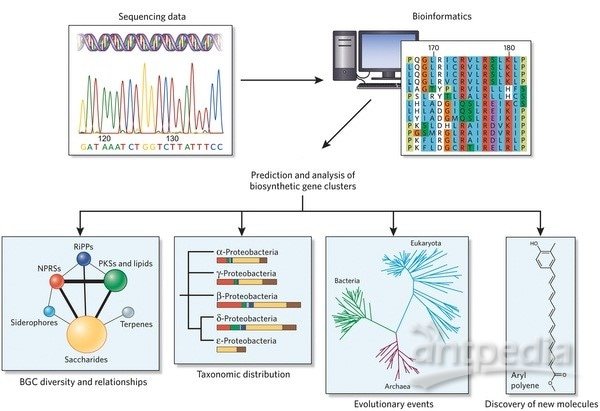
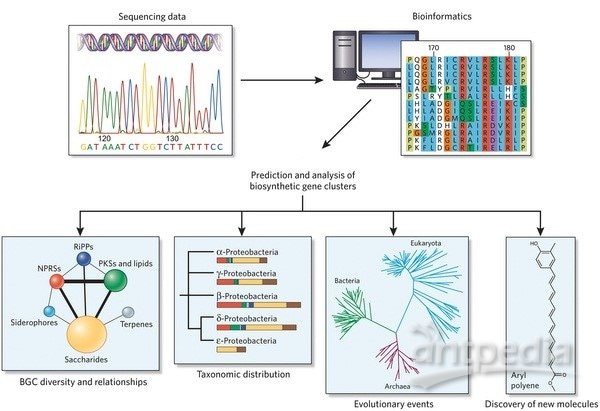
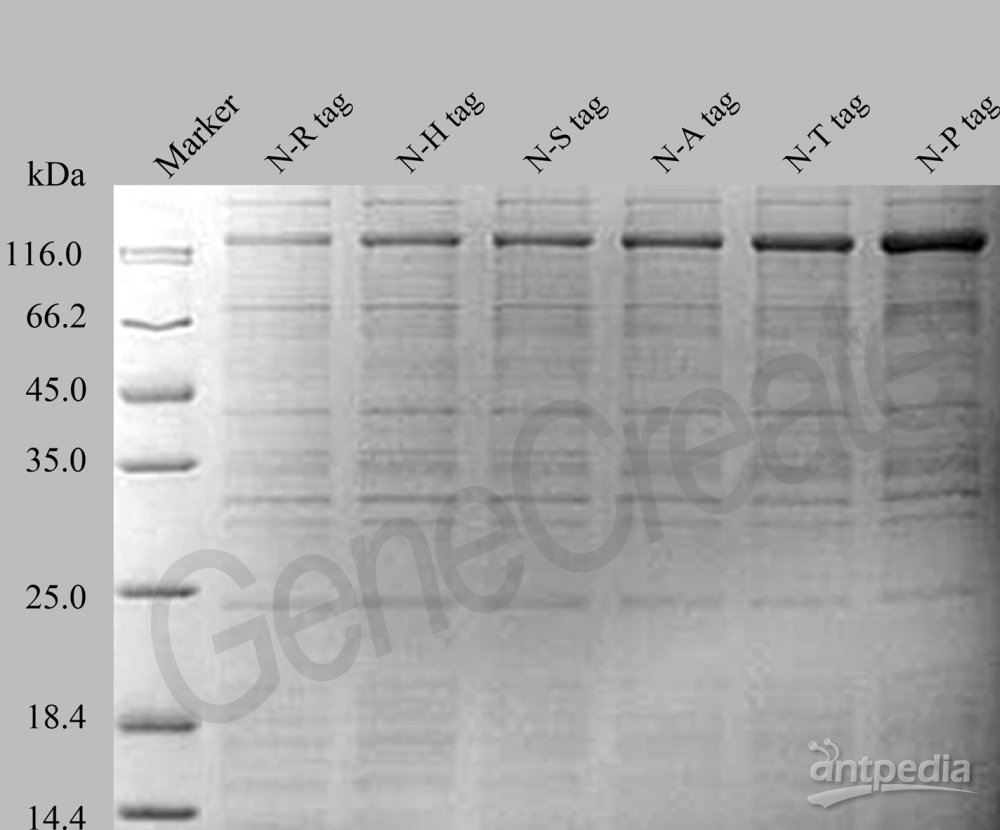
关于大肠杆菌重组蛋白表达系统解答
大肠杆菌(E.coli)重组蛋白表达技术经过多年的发展,相对于其他表达体系,算是非常成熟的一个体系。大肠杆菌蛋白表达系统主要有以下特点:遗传背景清楚;易于培养和控制;转化操作简单;表达水平高;成本低;周期短。本篇将对大肠杆菌重组蛋白表达系统的常见技术问题进行一一解答。
1:大肠杆菌表达体系的优点是什么?
(1)菌体繁殖速度快:20分钟倍增一次,这意味着按照1/100的比例接种(MOI),只需要几个小时培养基细菌即可到达稳定期;
(2)容易实现高密度培养:理论培养密度是1 × 1013 cells/ml,实际培养过程中使用LB培养基在37℃培养大肠杆菌,<1 × 1010 cells/ml。在低温(11℃)诱导蛋白表达时,细菌个数几乎不增长。
(3)转染外源DNA容易,质粒转染效率高。
2:选择什么样的质粒体系?
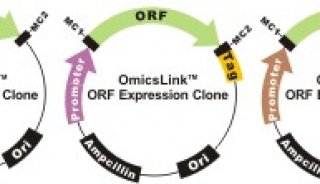
目前最为常用的重组蛋白表达质粒载体融合了复制子(Replicon)、启动子(promoter)、筛选标签(selection marker)、多克隆位点(MCS)和融合蛋白移出策略(fusion tag removal strategy)。
复制子:包含复制起始点及相关顺式作用控制元件(cis-acting control elements)。在选择合适的质粒载体时,质粒拷贝数应当是需要考虑的一个重要参数。几个常用的载体系列,如pET、pUC、pACYC 、pBAD和pSC101。pET系列载体含有pMB1起始子,在单个菌体中通常含有15-60 copies,通过改造pET载体,可以获得双表达质粒(BiPlasmid vector),该质粒含有双MCS位点,双T7启动子,双lac操纵子和双核糖体结合位点;pUC系列含有一个突变版本的pMB1起始子,在该系列的载体在单个细菌通常有500–700 copies;pACYC和pBAD系列常被用于双表达体系,如FRET系统,该系列含有p15A起始子,单个细胞含有10-12个copies;pSC101系列载体单个细胞中的拷贝数通常<5个,常被用于三种蛋白的共表达。
启动子:重组蛋白大肠杆菌表达体系中,lac启动子是最为常用的启动子之一。当培养基中只存在乳糖(lactose)作为wei一碳源时,lac启动子被激活,开始重组蛋白表达。常用带T7启动系统的pET系列载体表达目的蛋白,当含有T7启动系统的质粒转染进入细菌后,挑取单克隆,培养并加入IPTG(异丙基-β-D-硫代吡喃半乳糖苷,一种非水解性的乳糖类似物)诱导细菌表达重组蛋白。为了消除重组蛋白本底表达,可以在原先的pET系列质粒载体基础上加入T7溶酶体与T7 RNAP(RNA polymerase)共表达,T7溶酶体能够结合T7 RNA聚合酶并限制T7启动子介导的起始转录。
亲和标签:重组蛋白表达过程中采用亲和标签一方面是为了使蛋白纯化过程更加容易;另一方面是为了促进某些不溶性蛋白可溶。蛋白标签可分两类:一类是短肽类标签;一类是长肽以融合蛋白(fused partner)形式共表达。长肽类标签更多的作用是促进蛋白可溶性,往往需要同时加入短肽标签以帮助蛋白纯化;短肽类标签一般只含几个氨基酸,分子量均<2 kDa,对重组蛋白的性质影响较小。亲和标签可以放置在蛋白的C-端和N-端,如需要表达分泌性蛋白,则放置于C-端,信号肽放置于N-端。不同的蛋白标签需要根据具体需求进行选择。
3:去除蛋白标签的方法有哪些?
去除蛋白标签的方法分为两类,一类是酶消化法;一类是化学裂解法。化学裂解法通常被用于融合伴侣蛋白的移除,如CNBr用于裂解与Met氨基酸C-端连接的多肽,该方法优点是价格便宜,缺点是蛋白序列中不能存在Met氨基酸残基。酶消化法是目前最为常用的蛋白标签去除方法,如腸激脢(Enterokinase),凝血酶(thrombin),factor Xa和烟草蚀刻病毒蛋白酶 (TEV protease)等移除蛋白标签,只残留少数几个氨基酸残基。带有His标签的TEV蛋白酶逐渐被广泛接受用于蛋白标签移除实验,该蛋白酶具有一个非常优秀的特点:切除标签后,只残留一个Ser或Gly残基或完全不残留氨基酸残基。
4:什么是合适的蛋白表达宿主?
重组蛋白原核表达常采用BL21(DE3)和K-12衍生菌株作为表达宿主。BL21菌株缺乏Lon蛋白酶和外膜蛋白酶OmpT,Lon蛋白酶主要功能是降解外源蛋白,外膜蛋白酶OmpT主要功能是降解胞外基质蛋白。同时BL21菌株具有先天性的hsdSB基因突变,菌株失去甲基化和降解外源转染质粒的能力,使得质粒能够传代保留至子代细菌中(hsdSB突变基因来源于父辈B834菌株)。K-12系列菌株具有两大优点:一个是能够促进胞质中蛋白二硫键的形成,主要原因是trxB(thioredoxin reductase)基因发生突变;另外一个是recA基因突变,改基因突变后外源质粒在宿主菌种中得以稳定存在。
5:大肠杆菌表达体系为什么会出现无或低蛋白表达的结果?
诱导前后蛋白存在毒性或者表达过程中密码子有偏向性,都可能造成蛋白不表达或低表达的结果。建议从以下几个方面来解决问题:
1)控制本底表达水平:基于lac-based启动子表达,加入葡萄糖;选择以葡萄糖为碳源培养基;基于T7-based启动子表达,使用含有T7溶酶体质粒;使用严谨控制型质粒,降低拷贝数。
2)控制诱导表达水平:采用可调节启动子;采用可控制诱导菌株;降低拷贝数;采用适用毒性蛋白表达菌株;采取分泌性表达策略。
3)优化质粒DNA密码子,以适应宿主密码子体系使用密码子调整菌株。
4)增加生物质:尝试新培养基;改善通气条件,避免泡沐。
6:为什么会形成包涵体?
重组蛋白体系表达过程中,形成不正确的二硫键、进行错误的折叠、产生低可溶性蛋白,以及缺少翻译后修饰这一重要环节,都可能形成包涵体。可以采取以下策略来解决这些问题。1)使用胞质具有氧化功能的E. coli进行分泌性表达。2)共表达分子伴侣。3)补充含有化合物伴侣和共因子的培养基。4)移除诱导剂,增加新鲜培养基。5)通过低温诱导表达或调整诱导剂浓度来降低表达速率。6)改变融合伴侣蛋白,促进可溶蛋白表达。7)改变表达宿主,如原核改变成真核表达系统。