上海生科院揭示GCK激酶OSR1的活性调控机制
11月17日,国际学术期刊The Journal of Biological Chemistry 在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所周兆才研究组的最新研究进展Structural and Biochemical Insights into the Activation Mechanisms of Germinal Center Kinase OSR1,揭示了Germinal Center Kinase (GCK)激酶家族成员OSR1的活性调控机制。
周兆才研究组近年来主要集中于研究GCK,此前阐释了GCK成员MST1/2 (Hippo)及MST3/4的激活与信号调控(成果发表在Cancer Cell和Structure 等学术期刊)。本项工作是该系列研究的进一步延伸。
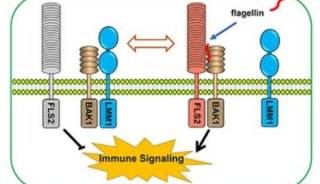
GCK激酶家族成员OSR1(Oxidative Stress-responsive Kinase-1)可通过磷酸化离子通道蛋白调节细胞渗透压,维持细胞体积和机体血压稳定,是一个潜在的治疗高血压等疾病的新型药物靶标。然而,由于OSR1的本底活性极低,阻碍了对其功能和相关抑制剂的研究。
在该项研究中,博士研究生李川川、冯淼、史竹兵,以及副研究员焦石等人对OSR1的激活机制进行了系统研究,提出了一个“双重锁”自动抑制模型(double lock auto-inhibitory model)。研究发现,由OSR1的CCT结构域和alpha-AL螺旋介导的双重自抑制使得OSR1表现出难以检测的本底酶活;而上游激酶WNK以及调节蛋白MO25则可以通过结合OSR1并诱导构象变化而解除其自抑制,释放激酶活性。这一工作有助于人们深入理解OSR1激酶活性及下游信号调控的精确机制,为进一步功能研究及抑制剂筛选提供基础。
该项工作得到科技部、国家自然科学基金委、上海市科委以及中科院的经费资助。
OSR1激酶双重自抑制及WNK/MO25介导其激活的模式图
-
科技前沿
-
技术原理

-
项目成果