凋亡试剂盒V13241和V13245检测步骤
实验方法该实验采用的是经过优化的喜树碱诱导Jurkat细胞系凋亡实验条件。其他类型的细胞需做相应调整。该试剂盒在传统及Attune™声波聚焦流式细胞仪上验证过,使用Attune™声波聚焦流式细胞仪时,各种流速(25 μL/min 到 1,000 μL/min)都可以。
1.用有效方法诱导凋亡;设一不加诱导的阴性对照。
2.孵育之后收集细胞并用冷的PBS洗涤。
3.制备1×annexin V 结合缓冲液:按10次分析的量计算,加1 mL试剂C到4ml的去离子水中。
4.制备100μg/mL的PI工作液:用45μl 1×annexin V 结合缓冲液稀释5μl试剂B,剩余可保存备用。
5.再次离心步骤2中收集的细胞,弃去上清,重悬在1×annexinV 结合缓冲液。计数并用上述缓冲液稀释至约1 × 106 cells/mL。按每次实验用量100μl准备充分。
6.在每100μl细胞悬液中加入5μl试剂A和1μl步骤4制备的PI工作液。
7. 室温孵育15min。
8. 孵育结束,加400μl 1×annexin V 结合缓冲液,轻轻混匀后置于冰上。
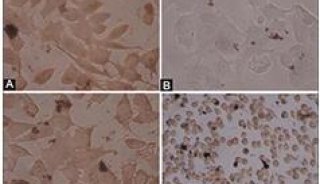
9.尽快对染色细胞进行分析。可用FL1检测530nm激发光,FL3检测>575nm的激发光。细胞群将被分为三组:活细胞显示弱荧光,凋亡细胞显示绿色荧光,而死细胞则同时发红、绿荧光。
10. 可用荧光显微镜验证结果,适用检测FITC、TRITC或Texas Red®的滤光片检测。
推荐