减少胃癌术后并发症,仅需增加这一步!
腹膜转移是胃癌患者术后复发的最常见模式。术中广泛腹腔灌洗(EIPL)是治疗局部晚期胃癌腹膜转移的新型预防策略。然而,尚不清楚EIPL的安全性和有效性。
目前,有3项多中心随机临床试验(RCT)正在开展,以评估EIPL作为局部晚期胃癌腹膜复发的标准预防性治疗的价值:日本CCOG1102 RCT、新加坡EXPEL RCT和中国SEIPLUS RCT。
中山大学肿瘤防治中心胃外科徐大志等开展的SEIPLUS RCT显示,若术中进行广泛腹腔盐水灌洗,局部晚期胃癌患者的术后并发症会更少,死亡率更低,伤口疼痛发生率也更低[1,2]。
研究结果近日发表于《JAMA Surgery》。
研究者指出,该研究是迄今为止支持EIPL的最大型研究之一。进行EIPL可提高D2(标准淋巴结切除术)胃切除术的安全性,减少术后短期并发症和伤口疼痛的发生。作为一种新的、安全的、简单操作,EIPL治疗很容易在任何地方进行,不需要任何特殊的装置或技术。另外,研究提示,晚期胃癌患者或是EIPL疗法的候选者。
同期述评
尽管对长期肿瘤学随访数据的需求提出告诫,但同期述评的作者对该研究给予了高度评价。美国维克森林大学Edward A. Levine指出,总的来说,即使超过一半的患者进行全胃切除术,死亡率也不到1%,这说明了本次试验中手术操作的高质量。
“用数字量表评估腹痛减少,这令人印象深刻。”Levine还指出,“实现短期结果的改善,总花费约20美元,这是我所知道的最便宜的‘镇痛剂’。EIPL简单、安全、低成本,从长远来看,具有减少‘可怕的’腹膜转移发生率的潜力。”
研究者介绍,腹膜转移是最常见的胃癌术后复发类型,与预后不良有关,中位生存期只有3~6个月。腹膜转移源自浆膜浸润性肿瘤的癌细胞直接播散,因此,在游离癌细胞固定到腹膜之前进行干预至关重要。
预防腹膜转移方法有两种:腹膜内化疗(IPC)和EIPL。其中,IPC的价值仍有待讨论,因为一些研究表明,IPC未能预防晚期癌症患者的疾病进展。虽然IPC联合EIPL的早期结果很令人鼓舞,但EIPL在晚期胃癌中的安全性和有效性仍未证实。最近一项涉及300名患者的日本试验表明,单纯胃切除术或联合EIPL治疗的3年或5年生存结果无显著差异。
该项研究旨在评估接受手术联合EIPL或单纯手术治疗的晚期胃癌患者的短期结果。
■ 研究细节
该研究于2016年3月至2017年11月在我国11家大型医疗中心开展,共招募662名接受D2胃切除术的晚期胃癌患者。其中329名患者被随机分入单纯手术组,333名患者被随机分入手术加EIPL组。在意向治疗人群中比较两组的临床特征、手术结果和术后短期结果。
研究中,患者随机接受标准腹腔灌洗液(<3L生理盐水)或EIPL(10L)。研究者每次给予盐水时,搅拌并洗涤腹膜腔,并将所有液体完全吸出。之后,患者接受氟嘧啶S-1和奥沙利铂的辅助化疗。
试验的主要终点是短期术后并发症和死亡率。3年结果分析预计将在2020年发布。因112名患者被发现为T1、T2或转移性胃癌而被排除,所以本次分析包括550名患者的数据;手术加EIPL组279例,平均年龄为60.6岁,单纯手术组271例,平均年龄为60.8岁。
本次分析的主要结果支持手术加EIPL组优于单纯手术组:
死亡率:0% vs 1.9%(5例),P=0.02;
术后并发症:11.1%(31例) vs 17.0%(46例),P=0.04;
术后疼痛:10.8%(30例) vs 17.7%(48例),P=0.02。
手术加EIPL组和单纯手术组患者术后并发症主要包括:肠梗阻(5.0% vs 6.3%)、腹腔脓肿(0.7% vs 1.9%)、腹腔内出血(1.08% vs 2.58%)、伤口问题较少(1.8% vs 2.6%)、深静脉血栓形成(0 vs 0.7%)、心脏病(0 vs 0.7%)和肺部疾病(2.5% vs 3.3%)。
阻断表观遗传“瑞士军刀”
或是治疗结直肠癌新策略
一项由中美学者共同开展的最新研究显示,阻断一种名为UHRF1蛋白的特定区域,则可打开数百种抗癌基因,从而削弱结直肠癌细胞在体内生长和扩散的能力[3,4]。
研究结果近日发表于《Cancer Cell》,由美国范安德尔研究所Scott B.Rothbart和Stephen B.Baylin以及我国华中科技大学同济医学院附属同济医院Limin Xia担任共同通讯作者。
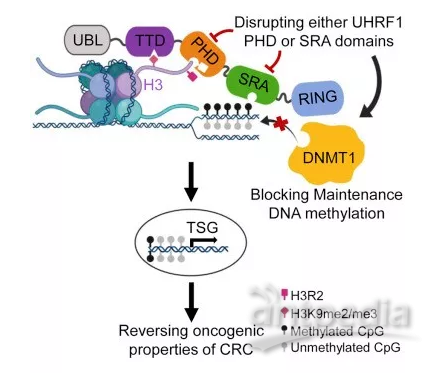
图1 在结直肠癌细胞中,组蛋白和半甲基化的DNA阅读器结构域对于UHRF1维持异常DNA甲基化至关重要。阻断任一结构域可逆转DNA超甲基化,重新激活表观遗传学上沉默的肿瘤抑制基因,并降低致癌特性。
Rothbart指出,近年来,UHRF1已成为驱动结直肠癌进展的生物过程的关键调节因子。该蛋白是一种类似于“瑞士军刀”的分子,有许多不同部分,而每个部分各司其职。通过揭示其驱动癌症进展的部分,或可为人们提供有希望的结直肠癌治疗新方法。
结直肠癌是美国男性和女性癌症相关死亡的第三大原因。自20世纪80年代中期以来,由于老年人进行常规筛查,结直肠癌总体发病率一直在下降。但是,结直肠癌是一个日益严重的公共卫生问题,尤其是对于尚未达到建议定期筛查年龄的年轻人。据2018年美国癌症学会的一份报告显示,在20至39岁人群中,结直肠癌发病率实际上是增加的;在1974-2013年期间,结肠癌每年增加1%~2%,直肠癌每年增加3%。
根据Rothbart等的研究,UHRF1或可助力结直肠癌治疗。
UHRF1帮助建立和维持DNA上的分子标签模式,这种表观遗传过程称为甲基化。这些甲基化模式就像一个开关,告诉身体细胞应何时打开或关闭特定基因。然而,在癌细胞中,这些模式发生改变,阻碍了细胞生长的正常检查与平衡,而使恶性细胞繁殖和扩散。
那么,UHRF1及其结构域在结直肠癌中究竟发挥怎样的作用?研究人员发现:
UHRF1通过其染色质阅读器结构域(reader domains)维持癌症特异性DNA甲基化;
UHRF1的PHD和SRA结构域突变体表型下调,可逆转DNA超甲基化;
破坏PHD或SRA结构域功能,可损害CRC细胞的关键致癌特性;
UHRF1高表达与肿瘤抑制基因(TSG)低表达呈负相关,且与结直肠癌预后不良相关。
此外,UHRF1是一个极具前景的新靶标,可作为新兴药物DNA甲基转移酶抑制剂(DNMTis)的补充;DNMTis在纠正甲基化错误和治疗癌症方面表现出了卓越成效。然而,迄今为止开发的许多化合物药物并不能同时穿透足够数量的肿瘤细胞,以致于完全修复甲基化并重新激活抗癌基因。
Baylin指出,表观遗传疗法是一种具有前景的治疗癌症途径,但需研发出能更好地逆转肿瘤的异常DNA甲基化、副作用更少的新药物。通过阻断维持甲基化的UHRF1结构域,进而引起强烈抗癌作用,或是开发新的、更有效DNMTis的关键。
研究人员利用美国国立卫生研究院癌症基因组图谱提供的数据发现,高水平UHRF1与更具侵袭性、难治的恶性肿瘤强烈相关。这提示,识别UHRF1的结构域,也可能有助于更好地识别结直肠癌亚型,从而改善临床实践中的个体化治疗。
研究人员表示,希望将其研究结果转化为可行的预后标志物,并最终转化成患者更耐受、更有效的抗击癌症疗法。
晚期结直肠癌患者
可从高剂量维生素D获益
美国Dana-Farber胃肠癌症中心Kimmie Ng等开展的SUNSHINE试验显示,高剂量维生素D联合化疗可延缓晚期或转移性结直肠癌(mCRC)患者的疾病进展[5,6]。
研究结果近日发表于《JAMA》。
研究者表示,该研究是首项关于维生素D补充剂用于mCRC的小型随机临床试验。基于其“非常令人鼓舞”的结果,今年晚些时候将在美国数百个研究点开展大型临床试验,以评估维生素D补充剂对mCRC的潜在益处。
维生素D是骨骼健康所必需的,通过依赖于阳光照射的化学反应在体内合成,也可通过含维生素D的食物或补充剂获得。实验室研究已证明,维生素D具有抗癌特性,例如引发程序性细胞死亡、抑制癌细胞生长和减少转移可能性。前瞻性观察性研究显示,血液中较高维生素D水平与结直肠癌风险降低和生存率提高有关,但这些研究无法证明维生素D是其原因。
在此背景下,研究者开展前瞻性、随机、双盲、2期SUNSHINE试验,在美国11个学术和社区中心招募139名mCRC患者,以评估维生素D补充剂是否可改善其生存预后。
研究中,所有患者均接受标准化疗,即mFOLFOX6加贝伐珠单抗。高剂量组(69例)患者最初每天服用8,000 IU维生素D,持续14天,之后每天服用4,000 IU,而标准剂量组(70例)患者为每天服用400IU维生素D组,均直至疾病进展、无法忍受毒性或撤出试验。在试验期间,要求所有患者不能服用任何其他维生素D或钙补充剂。
研究的主要终点是无进展生存(PFS),次要终点包括肿瘤客观缓解率(ORR)、总生存(OS)和血浆25(OH)D水平的变化。
结果发现,中位随访22.9个月,虽然高剂量组和标准剂量组的中位PFS无显著差异,分别为13.0个月(49个PFS事件)和11.0个月(62个PFS事件),肿瘤ORR(58% vs 63%)和OS(24.3个月vs 24.3个月)也无明显差异。但是,高剂量组患者疾病进展或死亡的可能性降低36%(PFS或死亡的多变量风险比为0.64,P=0.02)。
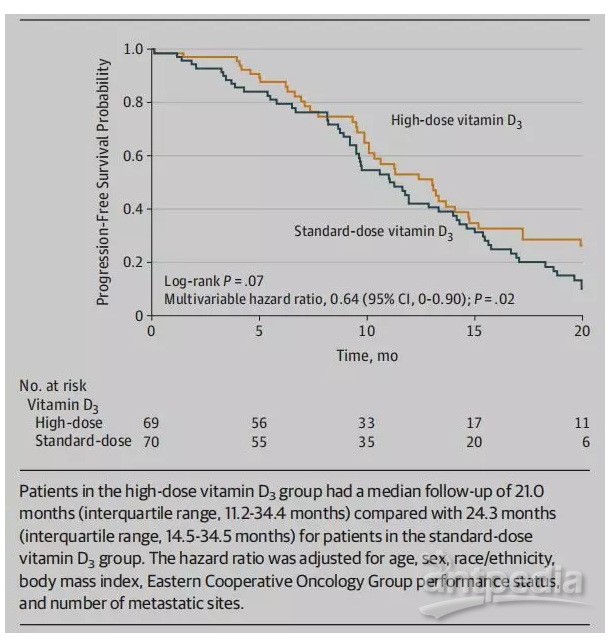
图2 两治疗组患者的无进展生存分析
此外,高剂量组和标准剂量组25(OH)D水平变化为:基线时(16.1ng/mL vs18.7ng/mL)无明显差异,首次分期(约治疗8周后,32.0ng/mL vs 18.7ng/mL)、第二次重新分期(约治疗16周后,35.2ng/mL vs 18.5ng/mL)以及停止治疗时(34.8ng/mL vs 18.7ng/mL)差异非常显著。
研究者介绍,试验中只有9%患者在治疗开始时有足够水平的维生素D。整个试验过程中,低剂量组患者的维生素D水平没有发生实质性变化,而高剂量组患者很快达到所需的足够维生素D范围并维持。
亚组分析表明,肥胖患者和携带KRAS基因突变的患者似乎从高剂量维生素D获益较少,这提示,这些亚组患者可能需要更高剂量维生素D发挥抗肿瘤作用。同时研究者还告诫说,除了在临床试验的范围内,不应服用高剂量维生素D。
研究者强调,该研究及其结果非常重要,因为它确定了一种具有成本效益、安全且易于获得的药物作为mCRC的潜在新疗法。因此,无论患者的社会经济地位或国家的资源如何,这都可能在全球范围内产生广泛影响。
参考文献
[1]Guo J, Xu A, Sun X, et al. Combined Surgery and Extensive Intraoperative Peritoneal Lavage vs Surgery Alone for Treatment of Locally Advanced Gastric Cancer: The SEIPLUS Randomized Clinical Trial[J]. JAMA Surg. 2019 Mar 27. [Epub ahead of print]
[2]https://www.medpagetoday.com/hematologyoncology/othercancers/78841?_ga=2.83353814.1140314137.1554694628-1627882608.1552633279
[3]Kong X, Chen J, Xie W, et al. Defining UHRF1 Domains that Support Maintenance of Human Colon Cancer DNA Methylation and Oncogenic Properties[J]. Available online 4 April 2019.
[4]https://www.sciencedaily.com/releases/2019/04/190404143626.htm
[5]https://medicalxpress.com/news/2019-04-high-dose-vitamin-d-benefit-patients.html
[6]Ng K, Nimeiri HS, McCleary NJ, et al. Effect of High-Dose vs Standard-Dose Vitamin D3 Supplementation on Progression-Free Survival Among Patients With Advanced or Metastatic Colorectal Cancer: The SUNSHINE Randomized Clinical Trial. JAMA. 2019;321(14):1370-1379.
-
项目成果









