非天然糖核苷酸的合成及其应用
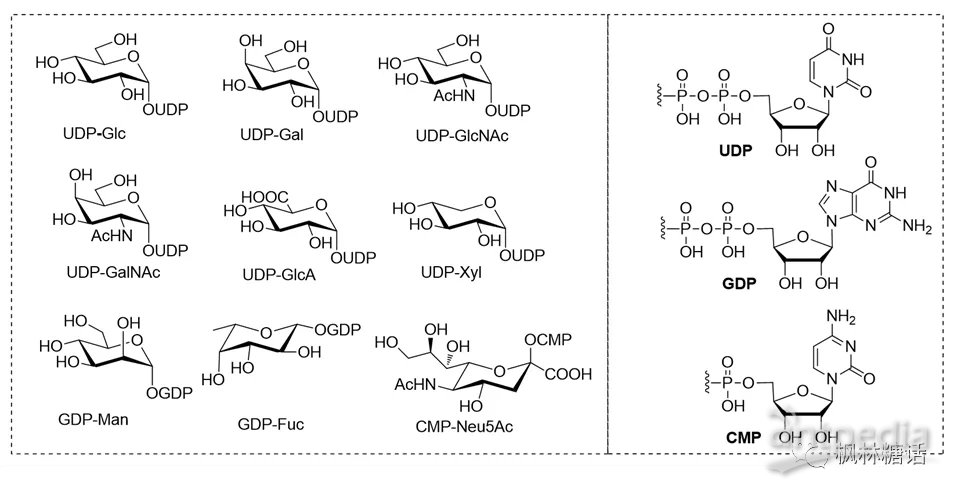
尽管自然界中的碳水化合物和糖复合物结构十分复杂,但人的糖蛋白和糖脂仅有九种构成单元:葡萄糖(glucose, Glc)、半乳糖(galactose, Gal)、N-乙酰氨基葡萄糖(N-acetylglucosamine, GlcNAc)、N-乙酰氨基半乳糖(N-acetylgalactosamine, GalNAc)、葡萄糖醛酸(glucuronic acid, GlcA)、木糖(xylose, Xyl)、甘露糖(mannose, Man)、岩藻糖(fucose, Fuc)和N-乙酰神经氨酸(N-acetylneuraminic acid, Neu5Ac)(如图1)[1]。这些构成单元必须被活化为糖核苷酸后,才能参与到不同糖链的构建中[2, 3]。糖核苷酸在结构上可分为两类:核苷二磷酸(nucleoside diphosphate, NDP)糖和核苷一磷酸(nucleoside monophosphate, NMP)糖,其中NDP-糖最为常见。尿苷二磷酸(uridine diphosphate, UDP)单糖是最常见的NDP-糖供体,在多糖生物合成途径中,它们能够被糖基转移酶或者合酶转移到糖基受体上构建糖苷键。天然和非天然UDP-糖都能够通过化学、酶法和化学酶法来合成[4-7]。虽然已有很多文献报道了天然UDP-糖的合成方法,但是目前针对非天然UDP-糖的合成和应用的探索还相对匮乏。这些非天然糖基供体有很大的应用前景,可作为酶底物用于功能性多糖和糖复合物的合成、酶抑制剂研究以及各种活性测试[4, 8]。因此,非天然糖核苷酸的合成在过去十年间一直都是研究热点。Wagner等人总结了从1999年到2009年NDP-糖、NMP-糖及其衍生物的化学合成进展[4],Thorson等人在2011年发表的有关糖基化的文章中详细总结了糖核苷酸的酶促合成途径(尤其是包括端基异构激酶和焦磷酸化酶的合成方法)及其底物和酶催化的转化[9]。这里,我们总结了非天然糖核苷酸,特别是尿苷二磷酸乙酰氨基葡萄糖(uridine diphosphate-N-acetylglucosamine, UDP-GlcNAc)/尿苷二磷酸乙酰氨基半乳糖(uridine diphosphate-N-acetylgalactosamine, UDP-GalNAc)类似物的化学法、酶促法和化学酶法制备方面的进展,及其在生理和药理学方面的生物技术应用。由于很难通过修饰天然糖核苷酸来获得非天然糖核苷酸[4],目前研究中主要由“两步法”合成策略来实现非天然糖基供体的合成:第一步是糖-1-磷酸(sugar-1-P)的合成,可以在此阶段实现结构的衍生化;第二步是二磷酸键的形成。同时,我们也介绍了糖核苷酸在过去十年中的新应用,包括碳链长度可控多糖的合成,稳定的同位素标记技术,酶促和代谢生物正交策略以及结构-活性关系(structure activity relationships, SAR)研究等。
1
糖核苷酸的合成
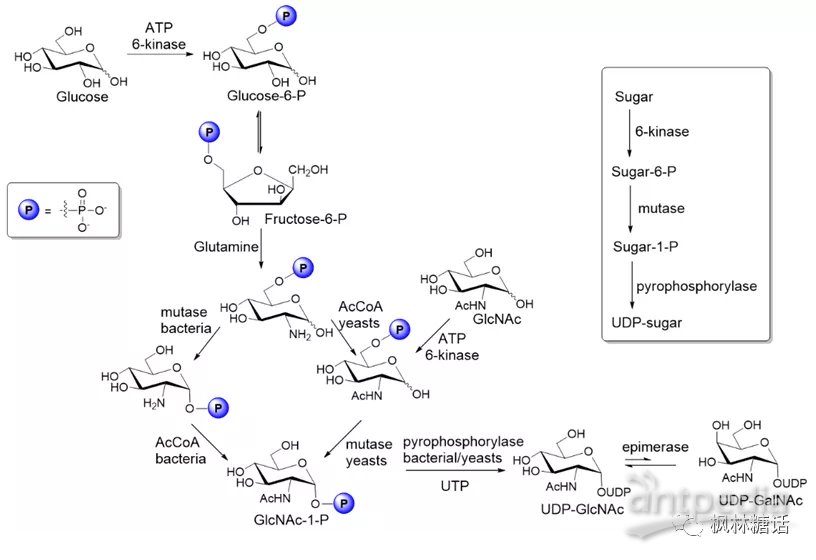
常见的糖核苷酸中的大多数共有相似的生物合成途径,即由6-磷酸葡萄糖和6-磷酸果糖作为关键中间体,以激酶和核苷酸转移酶作为关键酶。GlcNAc和GalNAc是很多重要多糖或糖复合物(比如糖胺聚糖(glycosaminoglycans, GAGs))的基本构成单元,所以对它们相应的核苷酸供体(即UDP-GlcNAc和UDP-GalNAc)的研究最为广泛[10,11]。在生物合成途径中,通常是由酶催化葡萄糖(de novo
pathway)或GlcNAc/GalNAc(salvage pathways)生成糖环1-位单磷酸化的中间产物GlcNAc-1-磷酸(GlcNAc-1-P),再对GlcNAc-1-P进行酶促焦磷酸化从而合成二磷酸供体UDP-GlcNAc[12]。UDP-GlcNAc/GalNAc的生物合成也可被进一步简化:用6-激酶将糖转化为的糖-6-P,糖-6-P再经变位酶转化为糖-1-P,糖-1-P紧接着被尿苷三磷酸(UTP)焦磷酸化得到UDP-糖(如图2)[5]。
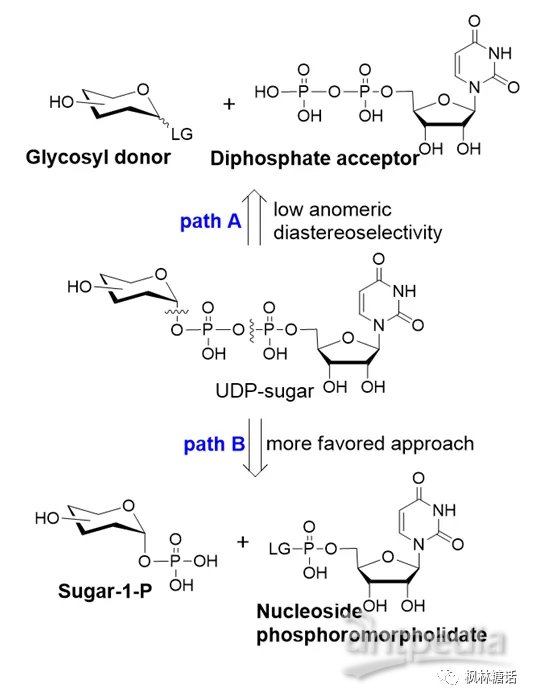
根据生物合成途径得知,核苷二磷酸糖合成的关键步骤是在核苷的5'-OH位和糖的异头羟基之间引入焦磷酸基团(如图3)[4]。目前研究中常用两种途径进行合成,第一种方法是将含离去基团的糖基供体(如卤化物)和核苷5'-二磷酸直接进行糖基化(如图3,path A)。但这种方法较难控制糖苷键的立体选择性。第二种方法是Khorana和Moffat开发的,目前更流行(如图3,path B):耦合单糖-1-磷酸和活化的核苷5'-单磷酸盐(如核苷磷酸吗啡酸盐)来构建焦磷酸键,最终产物的糖苷键构型可以通过糖-1-磷酸的立体选择性来控制[13,14]。
1.1
α-连接构型的糖-1-磷酸的合成
一般而言,控制糖-1-P的立体构型,再将其与活化的核苷5'-单磷酸酯偶联,可以控制UDP-糖基供体糖环和焦磷酸部分之间的糖苷键构型。到目前为止,对α-连接构型的糖-1-磷酸的合成方法的研究较为深入。
1.1.1
麦克唐纳反应(MacDonald reaction)
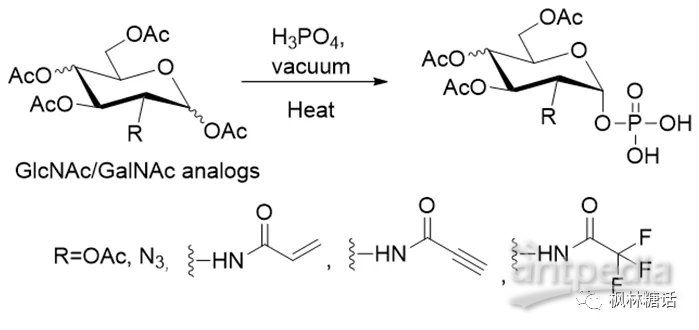
麦克唐纳反应是一种用于糖的单磷酸化的经典方法,反应过程是全乙酰基保护的单糖与磷酸在真空下进行的化学反应,以高选择性生成α-连接构型的糖-1-磷酸[15]。在这个反应的基础上,Masuko等人以30%-50%的产率构建了一个小型非天然GlcNAc-1-P和GlcNAc-1-P衍生物库(如图4)[16]。他们也证实了叠氮基和炔基在这种酸性条件下较稳定,因此,可以进一步通过点击化学反应进行荧光基团标记。UDP-三氟乙酰氨基葡萄糖(UDP-GlcNTFA)是在化学酶法合成硫酸乙酰肝素和肝素中一种常用的糖基供体,而在麦克唐纳反应的条件下三氟乙酰氨基也很稳定,所以也可以利用该反应合成α-连接构型GlcNTFA-1-P[17]。该方法也可用于其他糖核苷酸的合成,如α-D-阿拉伯呋喃糖-1-磷酸(α-D-arabinofuranose-1-phosphate, Ara-1-P)[18]、3-脱氧-α-D-阿拉伯己糖-1-磷酸[19]和2-脱氧-α-D-葡萄糖-1-磷酸[19]。然而,麦克唐纳反应的反应条件较为苛刻,一般不适用于热稳定性差的糖的合成,而且其产率普遍偏低,这限制了该方法进一步的应用[4]。
1.1.2
对半缩醛羟基进行磷酸化反应
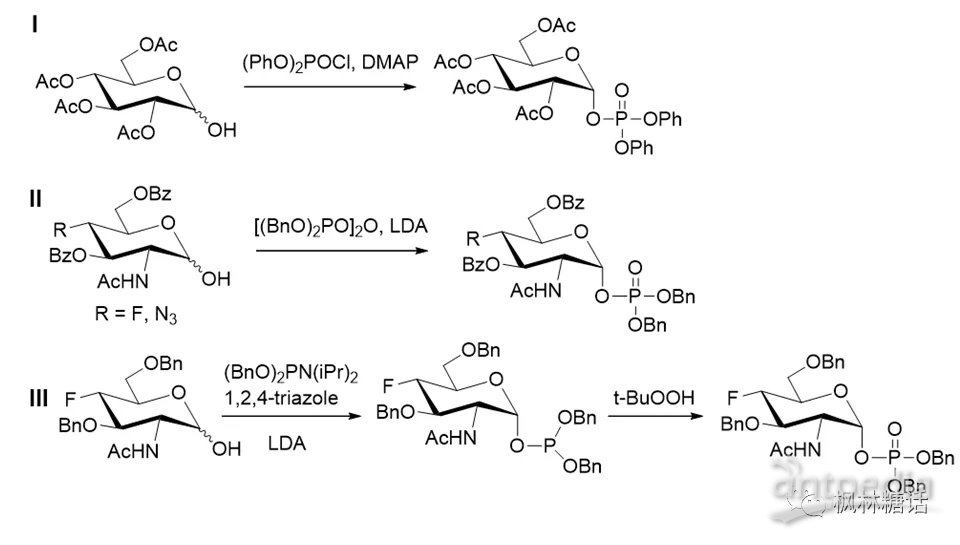
对糖环半缩醛羟基C-1-OH直接进行磷酸化是另一种构建α-构型糖-1-P的有效方法。半缩醛羟基和磷酸化试剂反应后能获得保护基保护的α-构型单磷酸,然后经过催化加氢即可将磷酸盐上的保护基团去除,获得α-连接构型糖-1-P。Sabesan和Neira等人通过4-二甲基氨基吡啶(4-dimethylaminopyridine, DMAP)催化糖半缩醛和二苯基膦酰氯耦合构建了α-糖苷键[20]。Dinev等人用同样方法制备了13C标记的全乙酰化葡萄糖-1-磷酸,其产率为83%(如图5-I)[21]。Schultz等人在二异丙基氨基锂(lithium diisopropylamide, LDA)存在下用四苄基焦磷酸进行磷酸化,生成了高α-选择性的磷酸化产物(如图5-II)[22,23]。他们发现氟、叠氮基在这种条件下也很稳定,从而可以构建氟、叠氮基修饰的非天然糖基供体。Feng等人(如图5-III)通过三氮唑催化二苄基二乙基胺基膦(dibenzyl
N,N-diethylphosphoramidite, DDP)与半缩醛,生成亚磷酸盐,随后氧化得到糖-1-P。虽然此反应没有立体选择性,产物为α,β混合物(α:β=1:1)[24],但后续在四氢呋喃中用叔丁基过氧化氢(t-BuOOH)处理这两种异构体时,β-构型的产物能快速异构化为α-异构体。但是,在选择氧化剂时,如果使用过氧化氢(H2O2),会破坏O-P键生成副产物。同样,Graziani等用双(苄氧基)-N,N-二异丙基氨基-磷化氢/1H-四唑成功合成了GDP-D-甘油-α-D-甘露庚糖,然后用叔丁基过氧化氢(tert-Butyl hydroperoxide, TBHP)氧化制备了关键的中间体α-磷酸盐[25]。该方法还可用于合成一系列糖-1-磷酸酯,例如D-甘露糖醛酸(D-mannuronic acid, ManA)-1-P[26],N-乙酰基尿酸(N-acetylmuramic acid,
MurNAc)-1-P[27],2-脱氧-α-D-葡萄糖-1-P,3-脱氧-α-D-阿拉伯己糖-1-P,
α-D-来苏糖-1-P和4-脱氧-α-D-lyxo-hexose-1-P[19]。
1.1.3
酶法途径
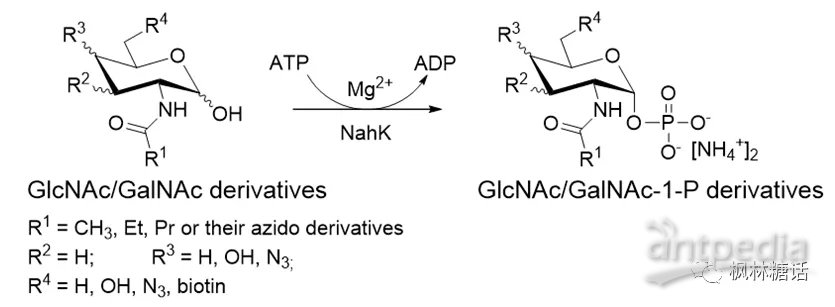
由于糖核苷酸在有机溶剂中的溶解度较低,且糖苷键和焦磷酸键不耐水解,通过传统化学方法合成糖核苷酸非常具有挑战性。另外,在化学合成过程中通常涉及多步的保护基操作和异构体分离纯化,其过程繁琐、产率低下。而酶法合成利用了酶催化的高效选择性,能够模拟糖苷键生物合成途径,具有高立体选择性和高区域选择性,有广泛的应用前景[5]。NahK(N-acetylhexosamine kinase)是一种N-乙酰己糖胺激酶,也是第一个被报道的野生型葡萄糖型1-激酶,可以快速有效地催化GlcNAc受体和5'-三磷酸腺苷(adenosine triphosphate, ATP)磷酸供体合成GlcNAc-1-P[28]。Zhao和Cai等人利用这种酶成功将非天然的GlcNAc/GalNAc类似物转换成了它们的1-磷酸化产物。并且他们发现这种酶的底物适用性非常好,无论糖环的C-4位羟基是平伏键或竖立键,都不影响酶对底物的识别(如图6)[29,30]。更重要的是,对糖底物的N-酰基进行多种正交基团的修饰,也不影响酶的识别。因此,通过此方法可以成功将一些正交基团标记到糖或糖复合物结构中去,便于进一步进行生物活性研究。另外,NahK可以与其他两种酶(Pasteurella multocida
N-acetylglucosamine 1-phosphate uridylyltransferasepm, PmGlmU和Pasteurella multocida
inorganic pyrophosphatase, PmPpA)结合使用,从而“一锅法”合成UDP糖衍生物,大大简化了合成过程[31]。
1.2
β-键构型的糖-1-磷酸的合成由于糖环端基的异构效应,相比α-构型,β-构型的吡喃糖磷酸很不稳定,所以其合成颇具挑战性。前面介绍的方法都无法实现β-构型的构建,目前也很少有文献报导β-键构型的糖-1-磷酸的合成。Oberthür等人利用α-构型糖基卤化物和四丁胺盐之间的SN2取代反应合成了β-构型2-脱氧糖磷酸(如图7-I)[32]。他们发现,更稳定的异头离去基团有助于磷酸化反应从SN1转换为SN2路径。同时,邻近基团的参与有助于磷酸化步骤中的立体控制。Timmons等人通过乙酰基或苯甲酰基保护的糖基溴化物和磷酸二苄酯的偶联,成功合成了β-L-岩藻糖/鼠李糖-1-磷酸(如图7-II)[33]。
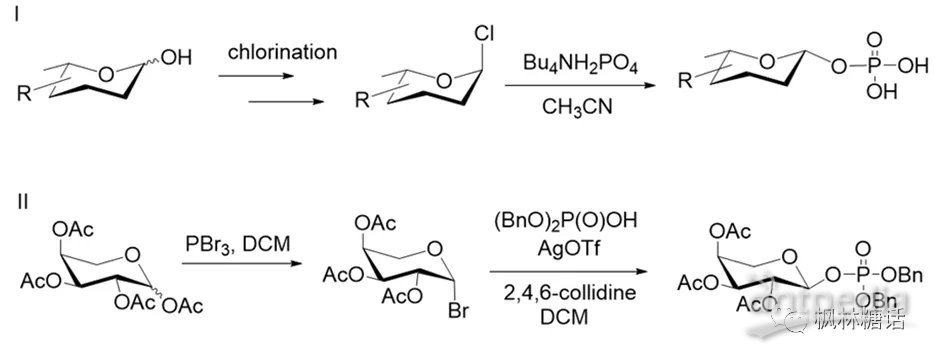
Prihar等人用邻亚苯基氯膦酸将甘露吡喃糖的半缩醛羟基磷酸化,得到β-D-甘露吡喃糖基-1-P[34]。同时,他们还使用MacDonald反应获得了β-和α-L-岩藻呋喃糖-1-磷酸的混合物(β:α=12:5)[35]。此外,酶促途径也可以实现β-构型糖-1-P的合成,如Stiller等人使用岩藻糖激酶合成了β-L-岩藻糖-1-P[36]。
1.3
二磷酸键的构建
1.3.1
化学法
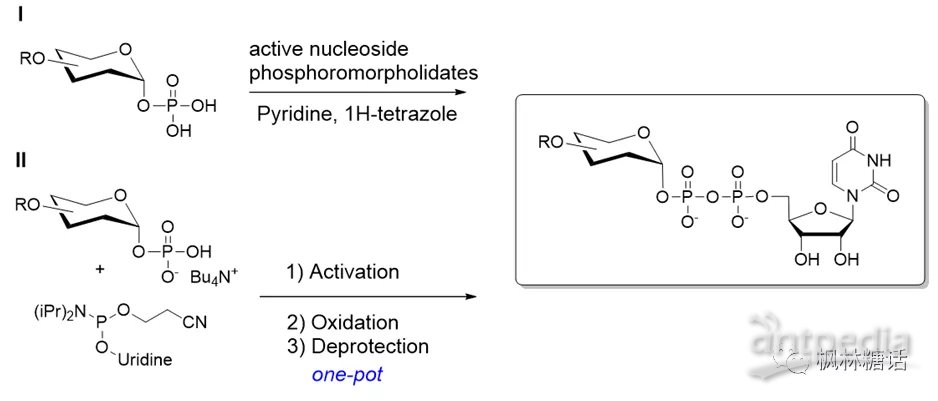
在化学法构建二磷酸键过程中,使用催化剂或各种活性核苷磷酸吗啡啉酸酯,可以改善从糖-1-P转化为UDP糖的反应时间和收率。例如,磷酸和尿苷-单磷酸吗啡啉盐在吡啶中的偶联效率很有限[25],引入催化剂1H-四唑后则能显著加快反应效率(如图8-I),而uridine 5′-monophosphomorpholidate 4-morpholine-N,N-dicyclohexylcarboxamidine salt是在生产UDP-糖过程中最常见的活性单磷酸吗啡啉盐试剂[22]。此外,一锅法也能有效提高得率,Gold等人基于糖磷酸盐和核苷亚磷酰胺的耦合,同步原位完成了活化、氧化和去保护,快速合成了UDP-N-乙酰氨基己糖衍生物。其中,中间产物中的亚磷酸基团可直接被t-BuOOH氧化成磷酸基,从而生成目标供体(如图8-II)[37]。除了UDP-GlcNAc /GalNAc外,化学途径还可以实现其他糖核苷酸的合成,如UDP-4-脱氧-α-D-木糖吡喃糖(UDP-D-Glc)[38]、UDP-N-乙酰胞壁酸[27]、UDP-D-岩藻糖[39]以及GDP-D-ManA[26]。
1.3.2
酶法和化学酶法
焦磷酸化酶通常用于连接一个糖基磷酸和一个核苷单磷酸形成UDP糖。例如,GlcNAc-1-P双转移酶(GlcNAc-1-P uridyltranferase,
GlmU)能够催化糖-1-P和UTP反应来合成非天然UDP-GlcNAc/UDP-GalNAc糖基供体[40]。同时,在催化过程中加入酵母无机焦磷酸酶可以降解副产物焦磷酸盐(PPi),推动反应向有利方向进行(如图9-I)[41]。Guan等人结合化学和酶法合成了一系列非天然UDP-GlcNAc/UDP-GalNAc类似物,这些衍生物含有多种可以进行生物正交反应的官能团,所以可用多种生物正交反应来方便地修饰基团(特别是对C-2-氮-位上的官能团的修饰),组成非天然核苷酸糖数据库(如图9-I)[41]。虽然底物中C-2-氮-位上的酰胺键是被GlmU识别的必须基团[16],但Guan等人发现修饰糖环的N-乙酰基、C-3、C-4、C-6等位置后,糖环仍然可以被GlmU识别,从而生成非天然糖基供体。并且,当C4位取代基更小时,酶催化效率更高[41]。因为GlcNAc/GalNAc的C-4位羟基活性较低,所以可以首先选择性保护其他邻近位点的羟基,进而能够对C-4位进行修饰,合成非天然GlcNAc/GalNAc衍生物[42]。据此,Zhang和Schultz等人研究了C-4位的非天然修饰(如图9-II)[22, 23]。他们发现4-OH基团上的修饰不影响GlmU的识别,故合成了4F GlcNAc-1-P和4F GalNAc-1-P,随后这两种非天然糖-1-P成功地在GlmU催化下与UTP反应构建了二磷酸键。这种构建二磷酸键的方法的得率很高,与化学合成的方法收率接近,远超过利用大肠杆菌JM109菌株(E. coli
JM109)的UDP-GlcNAc焦磷酸化酶的合成方法[24]。但是,研究人员也发现,GlmU不能识别4N3
N-乙酰氨基己糖-1-磷酸,其原因可能是叠氮基较大。