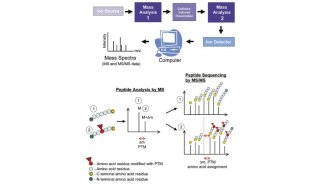
IgA1异常糖基化在IgA肾病的致病机制
IgA肾病发病机制中,IgA1异常糖基化致病机制是一个研究的热点。
虽然其学术地位重要,但是近年来出现了质疑之声。
本次学习笔记的要点就在于此。
IgA1分子的异常糖基化是导致 IgA 肾病发病的关键因素。
IgA1 异常糖基化主要是 指GalNAc末端无 Gal相连接, 表现为 O连接 N乙酰 半乳糖胺半乳糖基化的程度降低, 从而引起 N乙酰半乳糖胺单糖型糖基增多, 而半乳糖糖基化或唾液酸化的糖基形式减少, 半乳糖糖基总含量减少。

【1】IgA1的模型结构
IGA(顶部)铰链区氨基酸序列,具有六个O-聚糖(底部)的附着位点。
模拟的O-和N-聚糖被显示为球状:
红色为Gal-GalNAc,橙色为GalNAc,洋红色为N-聚糖。
铰链区非共基化氨基酸残基呈蓝色。
在IgA1铰链区最常见O-聚糖的六个位点是:
T225、T228、S230、S232、T233和T236。
(底部氨基酸序列中以星号标记)。
Fab包含由一个完整的轻链和一个重链的一部分形成的抗原结合位点的抗体的片段。
Fc为片段可结晶区域是抗体的尾部区域。
【2】IgA1-O-聚糖的宏观异质性和微观不均一性
正常人血清IgA1铰链区O-聚糖的位点特异微异质性 如下表。其总结了基于通过高分辨率质谱观测到的去唾液酸化O-糖肽的相对分布的结果。
该分布的得出是通过液相色谱-质谱和电子捕获分离-串联质谱鉴定的氨基酸位置异构体分析。
S230、T233和T23 6是正常血清IgA1中GAL缺乏和可变位置异构体的主要位点。
S225、S228和S232主要被Gal-GalNAc二糖所占据,这些位点很少被非糖基化或被缺乏Gal的物种所占据。
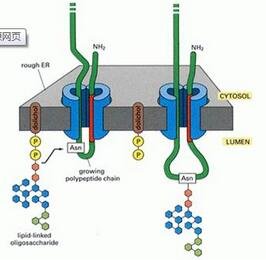
【3】IgA1分子 O-连接糖基化的生物合成途径
O-聚糖是逐步合成的,首先GalNAc附着在丝氨酸(Ser)或苏氨酸(Thr)的氧原子上,后者由GalNAc-转移酶催化。
此步骤之后,半乳糖(Gal)加入(由C1GalT1催化;分子伴侣Cosmc是产生活性C1GalT1酶所必需的)。
唾液酸(N-乙酰神经氨酸)可以通过不同的酶加入到每个聚糖中。
ST3Gal1与ST6GalNAcII这两种糖基转移酶分别催化 GAL和Galnac唾液酸化。
末端GalNAc的唾液酸化(不含GAL)可防止GAL的加入。
颜色编码是根据符号命名的聚糖而定:黄色正方形,GalNAc;黄色圆圈,Gal;黑色钻石,N-乙酰神经氨酸。
【4】四重打击致IgA肾病发病的学说
目前四重打击致IgA肾病发病的学说获得学术界广泛认可。
此学说认为IgA肾病患者循环中出现O-糖基化异常的IgA1分子(一重打击);
后来又出现针对这种异常O-糖链的IgA1自身抗体(二重打击);
这两种蛋白结合后形成循环IgA1复合物(三重打击);
这些复合物进而沉积在肾脏引起肾脏损伤(四重打击);
这些均导致IgA肾病的发生和进展。
【5】对于四重打击理论的质疑
☆关于IgA1在紫癜和IgA肾病中的作用依然不明之处甚多,解释起来都是四重打击,但是没有充分证据支持。
☆四重打击理论是有疑点的。虽然有不少研究发现了IgA肾病患者体内存在O-糖基化异常,并且高于正常人群,但仍有一些研究提出了质疑。
☆在中国人中只有50%左右的IgA肾病患者存在半乳糖缺失,在正常人中相当部分存在半乳糖缺失,但是并不发病。
☆新近的研究采用系列植物凝集素分离方法、 Western blot方法、酶修饰和质谱分析方法测定,发现lgA肾病中半乳糖缺失lgA1相对水平和正常对照之间并没有差异。