靶向TOX和TOX2有望改善CAR-T细胞免疫疗法对实体瘤的治疗
十年前,科学家们已宣布开发出一种称为CAR(嵌合抗原受体)-T的癌症免疫疗法:对来自患者的T细胞进行基因修饰,使得它们具有强大的抗肿瘤作用,随后再将这些经过基因修饰的T细胞灌注到患者自己的体内。从那以后,CAR-T方法(统称为“过继性T细胞转移”的几种策略中的一种)作为新型细胞免疫治疗工具成为头条新闻。迄今为止,它们最为成功地用于对抗所谓的“液体癌症(liquid cancer)”,如白血病和淋巴瘤。
肉瘤和癌症对这些方法更有抵抗力,这部分上是因为经过基因修饰的T细胞一旦浸润到肿瘤中就逐渐地失去抗肿瘤能力。免疫学家将这种细胞疲劳称为T细胞“衰竭(exhaustion)”或“功能障碍(dysfunction)”。
为了理解其中的原因,美国拉荷亚免疫学研究所的Anjana Rao博士和Patrick Hogan博士在过去几年中发表了一系列论文,报道了一种称为NFAT的调节基因表达的转录因子开启削弱T细胞抗肿瘤反应的“下游”基因表达,因而导致T细胞衰竭。其中的一组下游基因编码转录因子NR4A,而且前研究生Joyce Chen已发现通过基因手段清除肿瘤浸润CAR-T细胞中的NR4A蛋白可改善肿瘤排斥。然而,在这个途径中与NFAT和NR4A发挥协同作用的其他参与者的身份仍然未知。
如今,在一项新的研究中,Rao实验室和Hogan实验室在一个建立并维持T细胞衰竭的广泛基因表达网络中,提供了一个更为完整的参与者列表。这项研究利用小鼠模型发现通过基因手段清除两个新的转录因子 ---TOX和TOX2---也会改善CAR-T方法中对“实体”黑色素瘤的根除。它表明在患者中靶向NR4A和TOX因子的类似干预措施可能将基于CAR-T的免疫疗法的应用扩展到实体瘤中。相关研究结果于2019年5月31日在线发表在PNAS期刊上,论文标题为“TOX and TOX2 transcription factors cooperate with NR4A transcription factors to impose CD8+ T cell exhaustion”。
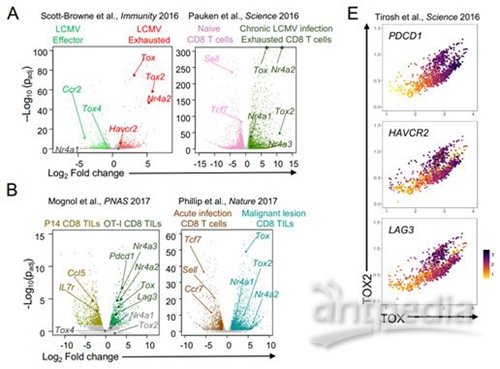
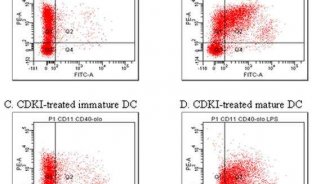
图片来自PNAS, 2019, doi:10.1073/pnas.1905675116。
他们首先比较了正常的与“衰竭的”T细胞样本中的基因表达谱,寻找与NR4A同时上调的因子作为T细胞功能障碍的同谋者。论文第一作者、Rao实验室博士后研究员Hyungseok Seo博士说道,“我们发现两种称为TOX和TOX2的DNA结合蛋白与NR4A转录因子一起高度表达。这一发现表明诸如NFAT或NR4A之类的因子可能会控制TOX的表达。”
他们随后在小鼠中重现CAR-T方案:首先将黑色素瘤细胞接种到小鼠体内以建立肿瘤,然后在一周后给这些小鼠灌注两种T细胞群体中的一种:来自正常小鼠的“对照”T细胞样本;来自经过基因改造后T细胞中不表达TOX和TOX2的小鼠的T细胞样本。
值得注意的是,相比于接受正常的T细胞灌注的小鼠,接受缺乏TOX的CAR-T细胞灌注的小鼠显示出更为强烈的黑色素瘤消退。此外,接受缺乏TOX的CAR-T细胞治疗的小鼠表现出显著增加的存活率,这就表明TOX因子的缺乏对抗T细胞衰竭并且允许T细胞更有效地破坏肿瘤细胞。
他们发现TOX因子与NFAT和NR4A联合起来促进一种称为PD-1的抑制性受体的表达。PD-1呈现在衰竭的T细胞表面上,并发送免疫抑制信号。
PD-1可通过许多称为免疫检查点抑制剂的单克隆抗体加以阻断,这些抗体抵抗免疫抑制并激活先天性抗癌免疫反应。
TOX、NFAT和NR4A在PD-1上的会聚在分子和免疫学上都有意义,这将使得人们能够将细胞免疫疗法和抗体免疫疗法结合在一起。
Seo说,“目前,CAR-T细胞疗法对患有白血病和淋巴瘤等‘液体肿瘤’的患者表现出惊人的效果。但是由于T细胞衰竭,它们仍然不能用于治疗实体瘤患者。如果我们通过用小分子处理CAR-T细胞来抑制TOX或NR4A,那么这种策略可能对黑色素瘤等实体瘤有很强的治疗作用。”