CAR-T细胞治疗质量控制浅谈(一)
细胞治疗,将改变人类疾病的治疗方式,由过去重复的症状控制转为一次性的治愈,是引领生物医学的希望。其中,嵌合抗原受体(CAR)T细胞疗法是近年来发展非常迅速的一种细胞治疗技术。
目前在全球已有两款药物获得FDA的批准上市,分别是诺华的Kymriah和凯特的YESCARTA,中国有多家公司产品进入临床申报或处于已获批阶段,这种疗法已成为更多患者的选择,CAR-T细胞制造过程符合全球监管要求成为广泛讨论的话题。

1.细胞治疗质量控制分析
其中细胞质量控制贯穿CAR-T从研发到临床的所有步骤,但CAR-T作为“活”的药物,其很多特性与传统药物有很大的差别,下表列举了与传统药物的主要差异点:

第一个上市的CAR-T药物Kymriah的释放标准涉及到多个方面的指标,下图是小编收集到的Kymriah的释放指标所需要测试的实验:

KITE的YESCARTA的质量控制也涉及到非常多的生物学实验,篇幅有限,就不一一列举了,具体指标可参考如下的链接:https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM584335.pdf
另一方面CAR-T制造工艺复杂,下图列举了CAR-T的制作流程,其中涉及到病毒转染,外源物质的引进,长时间培养等因素,这势必对质量控制提出了巨大的挑战。

2.细胞治疗质量控制原则及法规
基于以上原因,CAR-T细胞质量控制特别强调制备工艺的稳定性、多批次验证、全程质控和按照SOP严格操作。要建立稳定的质量检验和放行检验标准。

美国和欧洲出台了相应的法规来规范细胞治疗的质量控制,以下是国外针对细胞治疗出台的相关政策法规:

(大家如有需要,可至文末邮件索取资料)
在我国,细胞治疗的国家主管部门是国家卫生和计划生育委员会(NHFPC)和国家食品药品监督管理总局(CFDA),下图是我国针对细胞治疗出台的相关政策法规:

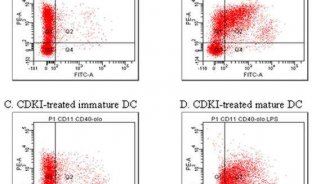
以下以CTL019为例来分析细胞治疗质量控制策略,目前细胞治疗产品的质量控制分为四个大的方面,分别为安全性(Safety),纯度(Purity),潜能性(Potency)以及均一性(Identity),这些质量控制会贯穿CAR-T生产的不同阶段,下图列举了这些检测会在不同的阶段开展。