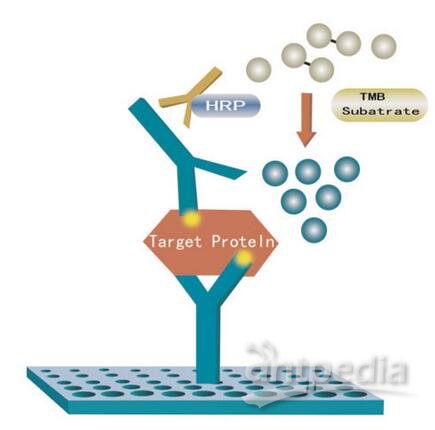
不可不知的ELISA开发方法(二)
⑥显色液和酶标仪:
显色液的选择需与酶联抗体的酶对应,也需和实验室所具备的酶标仪对应。
如酶联抗体偶联的是HRP(辣根过氧化氢酶),可以采用TMB显色液,用能够进行吸光度读数的酶标仪进行检测;
或者Ampliflu™Red为底物,用能够进行荧光读数的酶标仪进行检测;亦或采用QuantaRedADHP为底物,用能够进行化学发光读数的酶标仪进行检测。
一般来说,ELISA方法的灵敏度会受到底物的检测方法限制,化学发光底物能够检测的信号下限要优于荧光底物,再优于吸光度值底物。
即使是常用的TMB显色液,很多供应商不同显色强度的显色液,可以根据方法开发过程的具体情况合理选择显色液。
四、ELISA定量方法学开发实际案例分析
布局
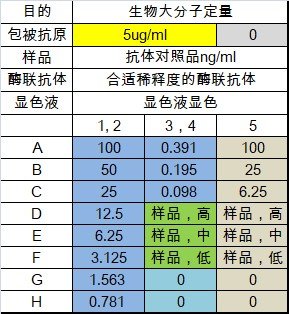
布局说明
增加了未包被(灰色)的分组,此分组是很有必要的,目的是为了确认待检测的样品或者对照品物质对酶标板材的非特异吸附。
样品进行低中高稀释,用来检测样品相对于对照品的平行性,即样品和对照品在相同的ELISA体系中是否具备相同的免疫学特性。
如果低中高样品的信号值在标准曲线合理的定量范围内,低中高样品经稀释倍数校正后的三组浓度值接近,说明样品和对照品平行性较好,平行性较差则该样品的检测不能用该对照品作为标准曲线。
一般操作流程
01.酶标板的制备:取浓度为100 ug/ml抗体,室温溶解,混匀用包被液按如下步骤稀释至5ug/ml,按加样布局表加入100ml/孔,分别加入酶标板条中 (Note 1),其中加入包被液做包被抗体的空白对照,2-8℃过夜。
02.用洗涤液洗板3次,拍干,加入300ml/孔封闭液(Note 2)室温封闭1小时;洗涤液洗板3次,拍干待用;
03.抗体对照品的梯度稀释和样品的高中低稀释(Note 3),100ul/孔加入微孔板中标准品稀释。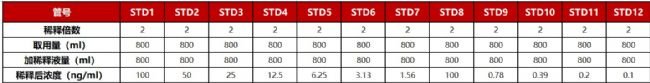
04.放入奥豪斯微孔板振荡器内,设置37℃、600rpm振荡1小时;

05.用洗涤液洗板3次,拍干;
06.酶联抗体稀释到合适的浓度(Note 4),在奥豪斯漩涡混合器上混匀,100ul/孔。

07.放入微孔板振荡器内,设置37℃、600rpm振荡1小时;
08.用洗涤液洗板4次,拍干;
09.取酶联抗体对应的显色液,临用前20分钟拿出平衡到室温,在漩涡混合器上混匀;
10.使用8道排枪以100 ml/孔加入显色液;
11.显色液室温避光放置10-30分钟(Note 5)
12.使用8道排枪以100ml/孔加入终止液终止反应;(根据底物的不同,此步可能不需要)
13.用酶标仪测定信号值;(Note 6)
14.结果分析(Note 7)
贴心的Note说明-经验总结
Note1:在包被过程中如果需要减少整个ELISA体系试剂对酶标板材的非特异吸附,建议选择疏水性酶标板材(polysorp),包被的抗体浓度要足量2-5ug/ul。
Note2:封闭液不一定能起到封闭效果,需要实验验证(未包被抗原的分组),一般来讲分子量越小的封闭剂效果越佳。
Note3:在方法学开发的初期可以拉大一下标准曲线的浓度范围1000ng/ml-0.1ng/ml。
Note4:酶联抗体的稀释需要做不同的稀释度进行比较选择,对于单抗成分的酶联抗体如果高低两个稀释度的酶联抗体能够产生一样的剂量曲线,说明酶联抗体过量,ELISA的信号传递未产生偏差。对于多抗成分的酶联抗体,其稀释度的判断较为复杂,可以根据标准曲线的最高浓度时的回测来判断酶联抗体浓度是否合适,如果对照品较高浓度的两个点信号值接近,说明多抗酶联抗体的浓度过低。
Note 5:对于吸光度值底物和荧光底物,仪器检测的信号值和显色时间成正比,控制在10-30分钟为宜。需要提前确认检测仪器的信号线性范围,比如一般的酶标仪吸光度值的信号线性范围在0-3,吸光度值在3-4之间为非线性的,在显色时应控制信号值不要超过3,或者将信号值大于3的点不列入标准曲线的拟合。
Note 6:不同底物需要用不同的仪器进行检测,吸光度读值,荧光读值,化学发光读值。在底物选择过程中注意实验室的酶标仪是否具备该种类型的读数功能。
Note 7:标准曲线的剂量曲线拟合可以是线性的,对数线性或者四参数拟合,检验标准是标准曲线各浓度点的回测偏差小于20%,如果不符合,删除最高浓度点,直至符合标准。
五、总结
仪器的检测信号的线性范围是有限的,如TMB显色液的信号的线性范围在0-3,ELISA方法开发和优化过程更多时候是对于对照品的信号值的控制和调整,以使得信号值在线性范围内。
使用增强型的TMB显色,延长显色时间,增加标准曲线的最高浓度点,增加酶联抗体的浓度等增强信号值,反之能够降低信号值。
在信号值的线性范围有限的情况下,尽可能的消除非特异吸附的信号值是方法灵敏的关键之一,选用疏水性酶标板材,采用分子量更小的封闭剂,采用相对简单单抗酶联抗体或者链霉亲和素酶联抗体等都是有效消除非特异吸附信号的形式。
在ELISA方法学开发过程中多样化的试剂耗材的合理选择和搭配是一个稳定,灵敏的ELISA方法的关键,而多样化试剂材料的特性的了解是选择的关键,这个需要在对比实验中根据信号的变化系统的去了解和剖析。
- 参考资料 -
1. ELISA技术应用概览和方法学开发初析
有助于宏观把握ELISA定量方法开发的原理
2. Decker J , Reischl U , Butler J E . SolidSupports in Enzyme-Linked Immunosorbent Assay and Other Solid-PhaseImmunoassays[M]// Molecular Diagnosis of Infectious Diseases. Humana Press,2004.
非常有用的ELISA综述,有利于全面了解ELISA的各个环节。
3. Desilva B , Smith W , Weiner R , et al. Recommendations forthe Bioanalytical Method Validation of Ligand-Binding Assays to SupportPharmacokinetic Assessments of Macromolecules[J]. Pharmaceutical Research(Dordrecht), 2003, 20(11):1885-1900.
ELISA定量方法系统的方法学验证过程介绍,有助于对ELISA方法的优劣进行全面评估
4. Findlay J W A , Dillard R F . Appropriate calibration curvefitting in ligand binding assays[J]. Aaps Journal, 2007, 9(2):E260-E267.
ELISA标准曲线不同函数进行拟合的比较文章。
5. Cox K L , Devanarayan V , Kriauciunas A , et al. ImmunoassayMethods[J]. 2012.
类似此篇文章的英文实验手册,可以借鉴学习下。
6. Pillutla R C . Book review: ligand-binding assays:development, validation and implementation in the drug development arena.[J].Bioanalysis, 2011, 3(3):271-273.