复宏汉霖PD-1美国上市之路启程,拟招募200名美国受试者
2022 年 11 月 29 日,复宏汉霖宣布一项 H 药汉斯状®(斯鲁利单抗)对比一线标准治疗阿替利珠单抗的头对头桥接研究已在美国完成首例受试者给药 (ClinicalTrials.gov 登记号:NCT05468489) 。这意味着该药在美国的上市之路已经迈出了坚实的一步。
基于 FDA 针对 H 药治疗广泛期小细胞肺癌(ES-SCLC)递交上市申请的正向反馈及FDA C 类咨询会议的讨论结果,该公司拟招募 200 名美国受试者参与此项桥接临床试验,以评估斯鲁利单抗在美国 ES-SCLC 患者中的疗效。
此前在 8 月,复宏汉霖已经对与 FDA 的沟通结果释放了相应预期,后续该药有望依据桥接临床结果向 FDA 递交上市申请。
首款突破小细胞肺癌的PD-1 单抗
斯鲁利单抗是首款在一线小细胞肺癌治疗上获得 III 期临床 OS 改善的 PD-1 单抗。
2021 年 12 月 7 日,复宏汉霖宣布随机、双盲、国际多中心 III 期临床试验ASTRUM-005 研究(试验登记号:NCT04063163) 取得积极结果,在第一次期中分析达到了总生存期(OS)的主要研究终点。这一结果标志着斯鲁利单抗有望成为全球首个一线治疗 SCLC 的抗 PD-1 单抗,为小细胞肺癌患者提供全新的治疗选择。而其上市申请也已经在今年 4 月份获国内 CDE 受理,当前正在审评中 (受理号:CXSS2200037) 。
12 月 17 日,复宏汉霖举办全球研发日,介绍了这项临床试验的期中分析详细数据;2022 年 6 月,相应临床结果在 ASCO 大会上作为口头报告发表。
纳入人群方面,ASTRUM-005入组了来自 6 个国家 114 家中心的 585 例未接受过系统治疗的 ES-SCLC 患者,按 2:1 随机分组至斯鲁利单抗联合卡铂+依托泊苷 (EC 方案) 组(斯鲁利单抗组,389 例)和安慰剂联合 EC 方案组(化疗组,196 例)。虽然入组人群中不含美国人,不过包含约 31.5% 的高加索人种。
疗效方面,ASTRUM-005 创造了 ES-SCLC 一线治疗 OS 新纪录。
截至2021 年 10 月 22 日,中位随访 12.3 个月,斯鲁利单抗组的中位 OS较化疗组已显著延长了 4.5 个月 [15.4 个月 (95%CI:13.3~NE) 对 10.9 个月(95%CI:10.0~14.3) ],显著降低死亡风险 37% [HR=0.63,95% CI:0.49~0.82,P<0.001]。12 个月 OS 率分别为 60.7% vs47.8%,24 个月 OS 率为 43.1% vs 7.9%,这意味着斯鲁利单抗组近一半的患者实现了两年 OS。
PFS 和 ORR 亦可看到明显改善,斯鲁利单抗组6 个月和 12 个月 PFS 率分别达化疗组的 2.5 倍和 4 倍(48.1% 对 19.7%,23.8% 对 6.0%); ORR 则达到 80.2%(312/389), 而化疗组为 70.4%。
ASTRUM-005研究总览图


截图来自Insight 数据库网页版
今年 8 月 30 日,据国外媒体 Fierce Pharma 报道,复宏汉霖首席执行官张文杰在接受采访时表示正在寻求国外合作伙伴,以将国产 PD-1 单抗「斯鲁利单抗」推向美国市场。
据报道,复宏汉霖当前已经和 FDA 沟通阐明了斯鲁利单抗的潜在 FDA 监管途径,计划开展一项美国桥接研究,在约 200 例美国 ES-SCLC 患者(包括黑人和西班牙裔)中评估斯鲁利单抗联合化疗相较于罗氏 PD-L1 单抗 Tecentriq 联合化疗的疗效,即今日完成首例给药的临床试验。
张文杰表示,对于这项适应症,FDA 只期望看到肿瘤响应率的改善即可,而非总生存期(OS)或无进展生存期(PFS)数据,因此研究有望较快完成。如若顺利,预计有望在两年内在美国获批上市。
而在国内,预计斯鲁利单抗的小细胞肺癌适应症有望在明年获得批准。据介绍,尽管斯鲁利单抗是国内第 13 个获批的 PD-(L)1 抑制剂,但目前市场拓展迅速,期望明年能够占据中国 PD-(L)1 抑制剂整体市场份额前五名,同时近期还将参与医保谈判,争取明年落地医保准入;复宏汉霖也期望能够在国内 ES-SCLC 中取代现有进口 PD-L1 单抗地位。
美国 SCLC免疫疗法由PD-L1占领,
国产 PD-1 能否夺下一杯羹?
在全球范围内,PD-1 单抗在小细胞肺癌适应症上战绩惨淡。K 药 O 药都曾获加速批准治疗小细胞肺癌,不过 III 期临床双双折戟,在去年的适应症撤回风波当中,百时美施贵宝和默沙东都表示自愿在美国市场撤回其 PD-1 单抗治疗小细胞肺癌的适应症。
2021 年度 PD-(L)1 单抗美国争议适应症概况
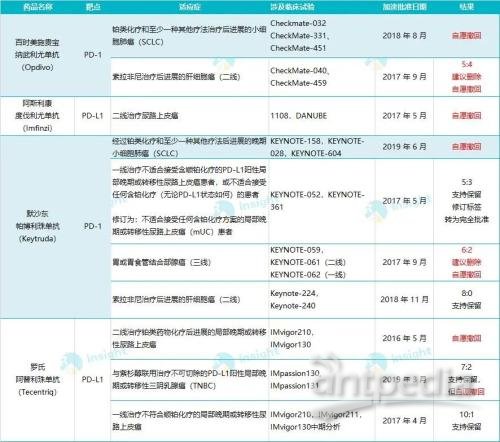
数据来自:FDA 官网,企业官网,Insight 整理
PD-L1 单抗成为硕果仅存的小细胞肺癌免疫疗法。目前在美国市场上仅罗氏的阿替利珠单抗(Tecentriq)和阿斯利康的度伐利尤单抗(Imfinzi)获批用于这一适应症。
度伐利尤单抗和阿替利珠单抗的获批分别基于 CASPIAN 研究 (登记号:NCT03043872) 和IMpower133 研究 (登记号:NCT02763579) 。
据 Insight 数据库临床结果对比显示,单纯数据来看斯鲁利单抗的 OS 获益高于两款 PD-L1 单抗;不过由于并非头对头研究,数据比较仅供参考,不能直接衡量疗效差异。
临床结果对比(建议点击图片放大查看):
两款 PD-L1 关键注册临床 vs斯鲁利单抗 III 期临床
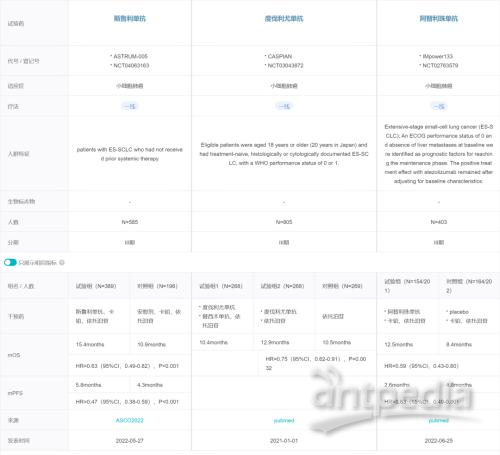
来自:Insight 数据库「临床结果对比」功能
*非头对头比较,仅供参考
后续随着斯鲁利单抗桥接临床试验的进行,我们有望从头对头比较 T 药的试验结果中更进一步了解到斯鲁利单抗治疗小细胞肺癌的获益程度。
国产 PD-1 向国际市场持续冲锋,
首个上市里程碑何时达成?
在国内卷而又卷的白热化竞争中,国产创新药已经接连向美国市场发起了冲锋,其中尤以 PD-(L)1 抑制剂最受瞩目。然而遗憾的是,目前为止几个重磅参与者都暂未冲过终点线,无论是基于 FDA 的监管要求演变、自身的 MRCT 研究开展、还是基于疫情因素。
目前距离审评结果最近的是君实生物(62.39 -5.61%,诊股)的特瑞普利单抗,PDUFA 决定日期在 12 月 23 日,仅剩不到 1 个月。如若顺利实现美国上市,无疑有望提振国产创新药的出海信心。
而近期,国产 PD-1 们正不约而同瞄准欧洲为首的全球其他国家,从百济的替雷利珠单抗单抗开始,该药最早在欧洲提交上市申请,到今年 Q3 还实现了在英国、澳大利亚、新西兰、韩国、瑞士等国家的上市申报,明年还计划联手诺华在美国递交胃癌、食管鳞癌、肝细胞癌三大一线适应症 sBLA;君实也在 11 月份接连完成了在欧洲、英国的上市申请。
国产 PD-1 单抗海外申报进展

数据根据网传信息手动整理,如有谬误还请评论区指正
把目光放到当下,国产 PD-1 单抗在美国申报的适应症实则各有千秋。
君实、正大天晴主攻鼻咽癌,这个适应症患者群体主要是亚洲人,在美国属于罕见癌种,在监管审批上有优势。百济选择了食管鳞癌,恒瑞则选择肝细胞癌,这两个癌种同样是亚洲发病率高于欧美的癌种,不过在全球范围内也位列 TOP10 癌症之列。复宏汉霖选择小细胞肺癌为突破口,则主要基于临床数据上的独特优势。
复宏汉霖如若后续在美国推进斯鲁利单抗的桥接临床并申报上市,预计需要两年左右的临床开展和 BLA 审评时间。届时国产创新药在海外又会是如何光景?犹未可知。不过期待在两 年之后,国产创新药已经走出中国,真正闪耀全球。
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角