《自然·癌症》:找到激活巨噬细胞的关键了
作为肿瘤治疗的主流手段,放射治疗(以下简称放疗)由于其有效性以及安全性,得到了广泛的应用[1-2]。然而,临床治疗结果表明,单独使用放疗,极少能根除肿瘤;由于其具有局部作用的特点,也难以抑制已转移的肿瘤。因此,将放疗与其他疗法联合使用,以达到系统性的肿瘤控制效果,是临床研究中的热点问题。
近年来,放疗与肿瘤免疫疗法的联合应用层出不穷,部分放射免疫联用策略也取得了喜人的结果。如声名显赫的PACIFIC疗法,将放疗、化疗以及免疫检查点抑制剂度伐利尤单抗联合,就在局部晚期非小细胞肺癌(NSCLC)治疗中大获成功[3]。
虽然如此,放射免疫联用策略仍面临着一定的挑战,其效果往往局限于部分癌种,无法抑制其他类型的肿瘤生长。针对不同癌种,探究特有的新型放射免疫联用策略,有着重要的意义。
近日,斯坦福大学的Julien Sage领衔的研究团队在Nature Cancer期刊发表重要研究成果[4],为针对小细胞肺癌(SCLC)的放射免疫联用策略,提供了一种新的思路。
他们发现,在临床前SCLC肿瘤模型中,阻断CD47分子,可激活巨噬细胞,增强放疗对局部肿瘤的控制作用。该联合疗法还能诱导系统性的免疫反应,有效抑制远端未放疗侧肿瘤的生长。
区别于常用的激活T淋巴细胞的免疫检查点抑制剂,如抗PD-1抗体,他们的研究使用了抗CD47抗体来激活固有免疫中的巨噬细胞,促进吞噬作用,这也为临床治疗中制定合理的放射免疫联用策略提供了新的灵感。
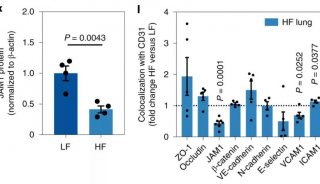
论文首页截图
已有研究表明,SCLC肿瘤细胞表面高度表达CD47分子,CD47可与巨噬细胞上的SIRPα分子结合,给巨噬细胞传递“别吃我”信号,从而削弱巨噬细胞对肿瘤细胞的吞噬作用,并进一步影响抗原呈递和后续的抗肿瘤免疫反应。
阻断肿瘤细胞上的CD47分子,有助于恢复巨噬细胞的吞噬作用,激活固有免疫,加强对肿瘤的抑制作用,而放疗也能激活固有免疫及适应性免疫,理论上来说,二者联合能有效抑制肿瘤。Julien Sage团队对此猜想进行了验证,并揭示了其中的机制。
胸外菁英TALK Vol.1,开疆拓土,ALK+NSCLC患者有望实现精准治疗早晚全覆盖
研究人员首先使用缺乏T细胞、B细胞及NK细胞的免疫缺陷小鼠(NSG小鼠)建立SCLC肿瘤模型,并分别对小鼠进行5 Gy放疗、抗CD47抗体治疗或二者的联合治疗。
结果表明,虽然接受治疗的小鼠肿瘤都受到不同程度的抑制,但是,联合治疗组的效果优于放疗或抗CD47抗体治疗组,肿瘤体积显著减小,瘤内浸润的巨噬细胞也显著增多。

放疗联合抗CD47抗体,抑制肿瘤生长,增加巨噬细胞浸润
而在免疫功能健全的荷瘤小鼠中,无论是使用药物阻断CD47,还是从基因层面敲除CD47,两种方法也都能与放疗联合,对SCLC肿瘤产生较强的控制作用,这也提示研究人员,放疗联合抗CD47抗体带来的抗肿瘤作用可能不依赖于T细胞,B细胞或NK细胞。
临床治疗中,放疗往往只能对照射处的肿瘤产生抑制作用,极少引发全身性的抗肿瘤免疫反应并杀伤转移灶肿瘤。那么,全身性阻断CD47与局部放疗联合,是否能产生系统性的抗肿瘤免疫反应,杀伤未照射肿瘤,带来远隔效应呢?研究人员又进行了如下探索。
Julien Sage团队于小鼠腹部双侧接种SCLC肿瘤细胞,分别对荷瘤小鼠进行抗CD47抗体治疗及单侧肿瘤5 Gy放疗。相较于单独放疗或单独抗CD47抗体治疗,放疗联合抗CD47抗体有效抑制了放疗侧的肿瘤生长,且未放疗侧的肿瘤生长也显著延缓。当使用联合疗法治疗有肝部转移灶的荷瘤小鼠,并测量同一只小鼠皮下肿瘤的体积时,也观察到了这种远隔效应。

放疗联合抗CD47抗体诱导了远隔效应
前面我们说到,即使在缺乏T细胞、B细胞以及NK细胞的NSG小鼠中,放疗联合抗CD47抗体也能有效的抑制肿瘤生长,而且瘤内浸润的巨噬细胞也变多了。其他实验也表明,这种联合疗法抑制放疗侧的肿瘤生长,并引发了远隔效应。研究人员推测,是不是巨噬细胞在这个过程中发挥了重要的作用呢?
答案是肯定的。单细胞测序结果表明,联合治疗后,未放疗的肿瘤内炎性巨噬细胞显著增多,流式细胞术也表明,未放疗的肿瘤内,不仅巨噬细胞数量变多了,其吞噬能力也变强了。而使用抗CD8抗体令荷瘤小鼠体内的CD8+T淋巴细胞耗竭,对于联合治疗所带来的远隔效应并没有影响。也就是说,巨噬细胞介导了放疗与抗CD47抗体联合疗法所带来的远隔效应。

放疗联合抗CD47抗体诱导的远隔效应依赖于巨噬细胞
基于以上数据,研究人员提出了一个新的问题,那就是在其他癌症模型中,是否也可以使用该联合疗法,诱发系统性的免疫应答,带来远隔效应?
他们采用了MC38结肠癌模型,对荷瘤小鼠进行10 Gy放疗及抗CD47抗体联合治疗。联合疗法有效诱导了放疗侧肿瘤的消退,也延缓了远端未放疗肿瘤的生长。表明该联合疗法的效果并不局限于SCLC肿瘤,在其他癌症中也能“大显身手”。

放疗联合抗CD47抗体可抑制结肠癌肿瘤生长并诱发远隔效应
与SCLC不同的是,MC38肿瘤模型对于以激活T淋巴细胞为主的免疫检查点抑制剂抗PD-1/PD-L1抗体有着较好的响应。对MC38肿瘤使用放疗、抗CD47抗体及抗PD-1抗体三重联合疗法,不仅诱导了放疗侧肿瘤的消退,对未照射侧的肿瘤还有着更好的抑制作用。
虽然放疗与抗CD47抗体的联合疗法诱导远隔效应不依赖T淋巴细胞,但是加入抗PD-1抗体后,激活的T淋巴细胞可能具有额外的抗肿瘤作用。

放疗联合抗CD47抗体及抗PD-1抗体,带来更强的肿瘤抑制效果
总的来说,这项研究表明,对SCLC肿瘤而言,将放疗与抗CD47抗体联合使用,可激活体内的巨噬细胞,在控制放疗侧肿瘤同时,还能引起系统性的免疫反应,诱导远隔效应的产生。如果该策略能转化至临床使用,将为转移性SCLC患者甚至是其他肿瘤患者带去福音。

参考文献:
1. Jaffray DA. Image-guided radiotherapy: from current concept to future perspectives. Nat Rev Clin Oncol. 2012;9(12):688-699. doi:10.1038/nrclinonc.2012.194.
2. Baumann M, Krause M, Overgaard J, et al. Radiation oncology in the era of precision medicine. Nat Rev Cancer. 2016;16(4):234-249. doi:10.1038/nrc.2016.18。
3. Antonia SJ, Villegas A, Daniel D, et al. Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med. 2018;379(24):2342-2350. doi:10.1056/NEJMoa1809697.
4. Nishiga Y, Drainas AP, Baron M, et al. Radiotherapy in combination with CD47 blockade elicits a macrophage-mediated abscopal effect. Nat Cancer. 2022;3(11):1351-1366. doi:10.1038/s43018-022-00456-0
责任编辑丨王雪宁
-
焦点事件

-
焦点事件