外泌体研究miRNA成果:带你揭秘长期运动对心脏的好处 2

图4. miR-342-5p在exe-exo提供的心脏保护中起关键作用
4.miR-342-5p通过靶向结合心肌细胞中的Caspase 9和Jnk2发挥抗凋亡作用
为进一步研究miR-342-5p的作用机制,作者预测了miR-342-5p的靶基因,发现Caspase3、Caspase9和Jnk2能参与MI/R损伤和凋亡途径(图5A)。接着作者又发现增加miR-342-5p后,可以显著降低Caspase9和Jnk2的蛋白水平,反之亦然,但没有观察到Caspase3基因表达的显著改变(图5B)。接着作者用荧光素酶进一步研究了Caspase9和Jnk2两个基因与miR-342-5p的结合位点(图5C)。此外,exe-exo孵育可以显著抑制H/R诱导的心肌细胞裂解-Caspase3、裂解-Caspase9和磷酸(P)-Jnk2的表达(图5D)。综上,这些数据表明miR-342-5p通过靶向结合Caspase9和Jnk2,在心肌细胞中发挥抗凋亡作用。
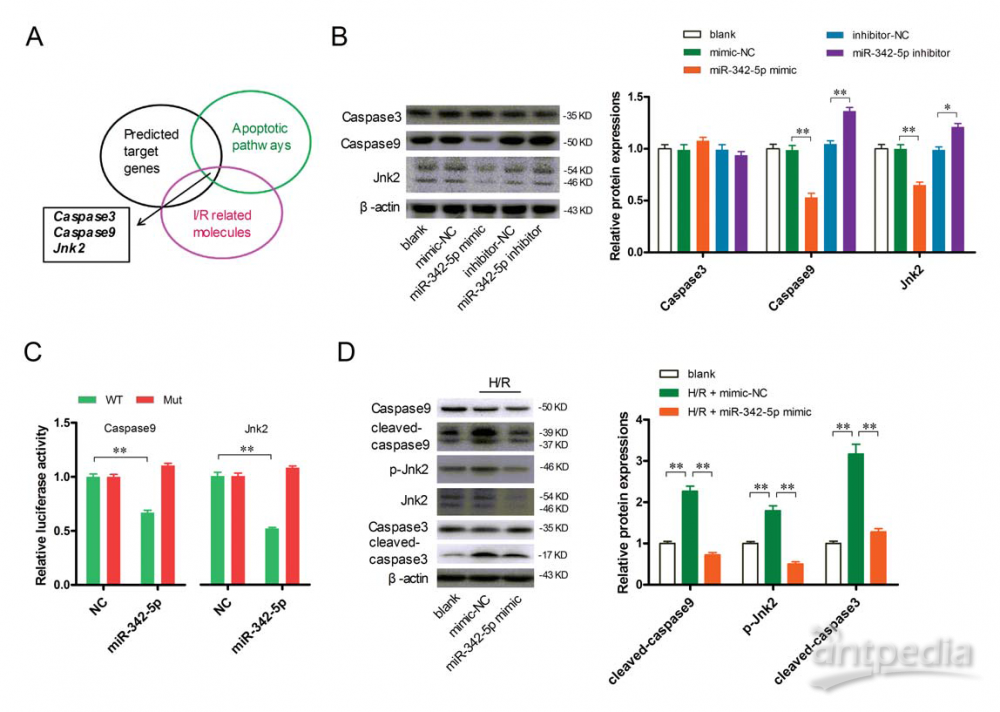
图5. miR-342-5p通过结合心肌细胞中的Caspase 9和Jnk2发挥抗凋亡作用
5.miR-342-5p通过靶向结合Ppm1f增强心肌细胞中AKT的磷酸化
生存信号AKT和ERK 1/2已被证实为心脏保护的关键分子。miR-342-5p可以上调心肌细胞中AKT的磷酸化,而ERK 1/2的磷酸化水平没有明显变化(图6A);在H/R心肌细胞中观察到类似的现象(图6B-D)。这些结果表明,miR-342-5p能激活心肌细胞的生存信号AKT。有趣的是,作者发现Ppm1f是miR-342-5p的潜在靶点,这是生信分析预测的唯一磷酸酶(图6E)。如图6F所示,miR-342-5p可以减少Ppm1f蛋白水平,反之亦然。荧光素酶报告分析进一步证实miR-342-5p可以直接结合Ppm1f的3'UTR区(图6G)。值得注意的是,下调Ppm1f蛋白表达不仅显著提高AKT的磷酸化水平(图6H-I),还可以降低H/R诱导的心肌细胞凋亡(图6J),这暗示AKT磷酸化水平升高可能在心肌保护中发挥作用。

图6. miR-342-5p靶向结合Ppm1f,增强心肌细胞中AKT的磷酸化
6.内皮细胞是运动分泌外泌体中miR-342-5p的主要来源
为探讨长期运动引起的大鼠循环外体miR-342-5p增加的原因,作者检测了大鼠心脏、骨骼肌、主动脉、肝脏、脂肪组织、肾脏、脾脏和血浆中成熟miR-342-5p及其前体的表达,发现成熟miR-342-5p在多个组织中均有表达(图7A)。而运动后,这些组织中的成熟miR-342-5p和前体miR-342-5p的量均显著增加,出乎意料的是,它们的增加主要发生在主动脉而不是骨骼肌或心肌细胞中(图7B-C)。进一步研究表明,去除主动脉内皮细胞后,成熟miR-342-5p和前体miR-342-5p的量可明显降低,暗示内皮细胞是主动脉miR-342-5p的主要来源(图7D)。接着,作者从运动大鼠和久坐大鼠中分离出主动脉内皮细胞,发现长期运动显著增加了内皮细胞中成熟的miR-342-5p和前体miR-342-5p(图7E)。此外,电镜发现内皮细胞质中存在典型的多囊体(MVBS),MVBS与质膜融合,释放外泌体进入循环(图7F)。这些结果提示血管内皮细胞是运动引起的外泌体中miR-342-5p的重要来源。
接下来,作者研究了内皮细胞释放的外泌体是否能被心肌细胞所吸收。作者用cy3标记内皮细胞分泌的外泌体,并将其添加到人的心肌细胞中(图7G)。共聚焦成像证实了cy3标记的miRNAs可以从内皮细胞向心肌细胞转运(图7H)。将cy3标记的外泌体与心肌细胞共同孵育,结果表明,受体心肌细胞中miR-342-5p增加(图7I)。更重要的是,受体心肌细胞在H/R损伤后凋亡减少(图7J)。综上,这些结果表明内皮细胞释放的mi-342-5p不仅可以被心肌细胞所吸收,而且可以保护心肌细胞免受H/R损伤。
7.层切应力(LSS)刺激可以上调内皮细胞miR-342-5p的表达
血流诱导的LSS是一种与运动有关的生理刺激物,被认为是运动诱导内皮细胞适应的中枢信号机制。为了研究LSS对miR-342-5p产生的影响,作者将人脐静脉内皮细胞,分别置于静止条件和LSS条件中培养。发现LSS不仅增加了细胞中成熟的miR-342-5p和pre-miR-342-5p(图7K),而且增加了外泌体miR-342-5p的分泌(图7L)。这表明运动诱导的LSS可以直接刺激内皮细胞产生和释放miR-342-5p。

图7. 内皮细胞是运动分泌外泌体中miR-342-5p的主要来源;
miR-342-5p可以被心肌细胞吸收,并保护心肌细胞免受H/R损伤;
LSS可以直接刺激内皮细胞产生和释放miR-342-5p
8.miR-342-5p在体内长期运动诱导的心脏保护中起着不可或缺的作用
为了探讨体内miR-342-5p在运动诱导的心脏保护中的作用,作者使用带有特定序列的病毒(AAV9)来抑制大鼠心脏中的miR-342-5p。游泳训练前一周,在大鼠心肌内注射AAV-anti-miR-342-5p或AAV阴性对照(图8A),在训练24小时后检测到转染AAV9。如图8所示,运动训练可以增加心脏中的miR-342-5p(图8B),同时减少Caspase 9、Jnk 2和Ppm1f表达,增强AKT的磷酸化;而降低miR-342-5p可减轻这些变化(图8C)。重要的是,运动后,MI/R损伤导致的大鼠心肌梗死面积(图8D-E)和心肌细胞凋亡(图8F-G)明显减少,降低miR-342-5p后,这种情况显著减弱(图8D-G)。在MI/R损伤前48小时注射miR-342-5p,可以显著升高大鼠心脏的miR-342-5p表达水平(图8H),缩小心肌梗死范围(图8I)。综上,这些体内数据表明,在长期运动诱导的心脏保护中,miR-342-5p对抵抗MI/R损伤起着至关重要的作用。

图8. 在运动诱导的心脏保护中,miR-342-5p对抵抗MI/R损伤起重要作用
总结:
长期运动衍生的循环外泌体,虽然其血浆水平没有显著变化,但对MI/R损伤提供了深远和持续的心脏保护。作者发现外体miR-342-5p是抑制凋亡信号(Caspase9和Jnk2),增强心脏存活信号(P-Akt)的关键心脏保护分子。血管内皮细胞可能是外泌体miR-342-5p的主要来源,表明在运动提供的心脏保护中,血管与心脏之间的相互干扰。这些发现揭示了运动给予心肌保护可以作为一种新型的心肌保护作用机制,突出了miR-342-5p在缺血性心脏病预防和康复中的治疗潜力。
-
科技前沿