Molecular Cell | 邵峰团队揭示新型糖基化修饰的催化机理
糖基化修饰是自然界最重要的蛋白质翻译后修饰之一。根据糖基修饰与蛋白质的连接方式和修饰位点的不同,以及糖基是单糖或寡糖的不同,主要可分为如下几类:

2013年来自中国和澳大利亚的两个研究小组,在Nature发表文章,报道来自细菌的三型分泌系统效应蛋白NleB可以对死亡受体复合物中的接头蛋白TRADD/FADD/RIPK1的死亡结构域(deathdomain,DD)进行精氨酸N-乙酰葡萄糖胺化修饰【1,2】。该修饰使得死亡结构域蛋白失去寡聚能力,从而在肠致病性大肠杆菌EPEC感染时,因为有NleB的存在,而抑制TNFR,FAS,TRAIL-R等多种死亡受体介导的炎症反应和细胞死亡,利于其在宿主体内定殖。
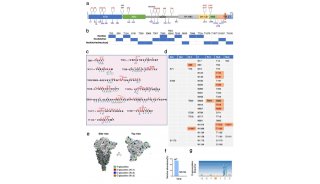
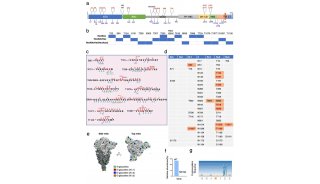
2019年4月9日,来自北京生命科学研究所的邵峰课题组,在Molecular Cell发表题为Structural and Functional Insights into Host Death Domains Inactivation by the Bacterial Arginine GlcNAcyltransferase Effector的研究,研究人员解析了NleB单体(酶单体),NleB/FADD DD/UDP复合体(酶/底物/糖基配体三元复合体),发生精氨酸N-乙酰葡萄糖胺化修饰的RIPK DD和TRADD DD(修饰后的两个蛋白底物),发现NleB的催化机理与以往报道的来自细菌的多个O-连接糖基转移酶(Lgt1,a-Toxin,TcdA/B,PaTox等)不同,是一种“翻转型”糖基转移酶(inverting glycosyltransferase),揭示精氨酸N-乙酰葡萄糖胺化修饰的酶学机理,酶和底物识别机制以及其酶学活性在动物感染模型中的作用。

死亡结构域最著名的的生化性质是通过自体或异体相互作用,形成寡聚体来传递信号,所以对其晶体结构的研究是结构生物学中的热点和难点。当死亡结构域蛋白发生精氨酸N-乙酰葡萄糖胺化修饰后会失去寡聚能力。在原核或真核共表达甚至病原菌感染体系中,NleB对TRADD,FADD和RIPK1的死亡结构域修饰比例可以达到百分之百。研究人员解析了修饰后的TRADDDD和RIPK1DD蛋白的晶体结构,可以看到N乙酰葡萄糖胺(GlcNAc)以b-构型连接在死亡结构域蛋白对应的精氨酸上。
在NleB/FADDDD/UDP复合体(酶/底物/糖基配体三元复合体)中,研究人员发现NleB形成一个C型凹沟,球状的死亡结构域蛋白正好嵌入其中,复合物中的NleB与单体的NleB相比,C型凹沟变小,使其与死亡结构域蛋白更加嵌合。
人类基因组中有大于30个死亡结构域蛋白,其中12个含有保守精氨酸(NleB的修饰位点),研究人员利用课题组前期制备的特异性识别精氨酸N-乙酰葡萄糖胺化修饰的抗体【3】,发现在原核体系中,NleB可以修饰TNFR1,FAS,DR3等受体,而不能修饰DR4和DR5。他们将酶和底物结合区域的重要氨基酸进行突变分析,发现DR5的Lys369变成可被修饰底物中的氨基酸Asp,DR5就可以被NleB修饰,与之相对应,NleB中可能与DR5的Asp369突变体相互作用的位点Lys289和Lys292如果变成Asp289和Glu292,则NleB也获得的修饰DR5的能力,进一步说明酶和底物精细的识别机制调控了NleB对死亡结构域蛋白特异的修饰。
FADD-DD的117位精氨酸,插入并稳定在NleB蛋白内一个由5个以上氨基酸组成的很窄的裂口中,NleB的Glu253与Arg117形成氢键,作为“碱”活化被修饰的精氨酸,发生如图所示的电子转移,最后形成b-构型的糖苷键,研究人员也在晶体结构和NMR核磁数据中进一步证实了该糖基化修饰的构型,揭示NleB是一种“翻转型”糖基转移酶。这与目前发现的来源于细菌的能对丝氨酸/苏氨酸发生O-Glucose或O-GlcNAc修饰的毒素蛋白所采用的“保留型”机制都不同。2017-2018年陆续有文章报道,从NleB的同源蛋白SseK1或SseK3的单体结构或与SseKs-UDP复合物结构中,推测SseK及NleB家族,可能与以往的毒素一样也是“保留型”糖基转移酶,而本文的研究人员通过解析多个被修饰后的底物的晶体结构、核磁结构,解析酶和底物复合体结构,发现NleB家族是“翻转型”糖基转移酶。

最后,研究人员发现NleB可以抑制FADD与上游FAS,DR4,DR5和RIPK1的结合,也可以抑制TRADD与上游TNFR1,及下游RIPK1和FADD的结合,由于NleB可以有效的修饰多个死亡受体相关蛋白的死亡结构域,它是一个多效的死亡受体信号通路抑制剂。
参考文献
1. Li,S., Li, S., Zhang, L., Yao, Q., Li, L., Dong, N., Rong, J., Gao, W., Ding, X.,Sun, L., Chen, X., Chen, S., Shao, F., 2013. Pathogen blocks host deathreceptor signalling by arginine GlcNAcylation of death domains. Nature 501,242–246. doi:10.1038/nature12436
2. Pearson,J.S., Giogha, C., Ong, S.Y., Kennedy, C.L., Kelly, M., Robinson, K.S., Lung,T.W.F., Mansell, A., Riedmaier, P., Oates, C.V.L., Zaid, A., Mühlen, S.,Crepin, V.F., Marches, O., Ang, C.-S., Williamson, N.A., O’Reilly, L.A.,Bankovacki, A., Nachbur, U., Infusini, G., Webb, A.I., Silke, J., Strasser, A.,Frankel, G., Hartland, E.L., 2013. A type III effector antagonizes deathreceptor signalling during bacterial gut infection. Nature 501, 247–251.doi:10.1038/nature12524
3. Pan,M., Li, S., Li, X., Shao, F., Liu, L., Hu, H.-G., 2014. Synthesis of andSpecific Antibody Generation for Glycopeptides with Arginine N-GlcNAcylation. Angew. Chem. Int. Ed. 53, 14517–14521. doi:10.1002/anie.201407824