Nature | 转移灶示踪新方法发现具有干细胞特性实质细胞
肿瘤微环境(tumor microenvironment, TME)不但为肿瘤细胞提供了生存和增殖的土壤,还可以改变肿瘤细胞的增殖和侵袭行为,二者之间的相互作用促进着肿瘤生成、迁移转移、血管生成、免疫抑制及靶器官选择等过程发生。以往的多项研究表明,微环境中如激活的成纤维细胞、周细胞、内皮细胞、炎症相关细胞等多种类型细胞都能够影响肿瘤细胞的特性【1】。肿瘤细胞转移早期,会在肿瘤细胞周围形成转移龛/局部TME(metastasis niche/local TME),这种环境不同于正常的组织结构,能够极大的促进肿瘤生长【2】。然而,目前,还没有针对转移微环境内细胞示踪和组成详细分析的研究,尤其是缺乏对转移早期过程中的微环境内细胞变化的研究。
近日,来自英国 The Francis Crick Institute的 Ilaria Malanchi团队在 Nature杂志上发表了名为 Metastatic-niche labelling reveals parenchymal cells with stem features的研究论文,该研究团队通过改造具有转移能力的肿瘤细胞,使这些细胞能够释放出具有细胞穿透性的荧光蛋白,这些荧光蛋白随即被肿瘤周围临近细胞所摄取,进而使得肿瘤细胞周围微环境空间内细胞变得可视化,研究人员在乳腺癌肺转移模型中对这个方法的可行性进行了充分验证,并发现了一类具有干细胞特性、能够自我更新、具有多谱系分化潜能的肿瘤相关实质细胞(parenchymal cells)。

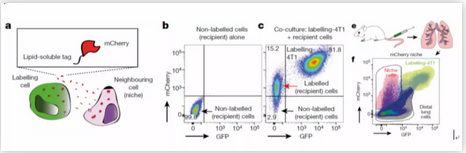
为了更好地辨别肿瘤细胞的周围细胞,研究人员首先开发了mCherry标记微环境系统(mCherry niche-labeling system):sLP-mCherry (secreted lipid permeable -mCherry)。这个系统包含了一种合成的带有mCherry荧光的分泌蛋白,这个蛋白同时携带有一段修饰过的具有脂质穿透性的反式作用元件转录肽段(TATk)。将乳腺癌细胞4T1共表达sLP-mCherry和GFP后与未标记细胞进行共培养发现,具有标记的癌细胞分泌出的sLP-mCherry蛋白能够进入到周围未标记细胞,细胞内荧光半衰期为43h并能持续保持高荧光强度。更重要的是,将这种sLP-mCherry+GFP+乳腺癌肿瘤细胞尾静脉注射到动物体内,构建乳腺癌肺转移模型过程中发现,这些细胞能够很好的影响其周围未标记组织细胞,大约能够影响其周围由内向外五层细胞层,且随着肿瘤微转移范围的扩大,mCherry+细胞也在等比例增加。由此证明,这种方法能够很好的标记局部肿瘤转移灶,使得组织内空间细胞组成和同一组织内标记细胞和未标记细胞的比较分析成为可能。
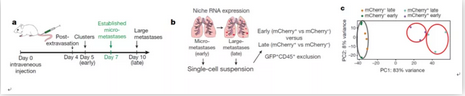
接下来,研究人员通过使用这个系统,对肿瘤细胞肺微转移组织内肿瘤周围细胞组成进行研究分析。以往的研究发现,肺中性粒细胞(neutrophils)对于能够促进肿瘤细胞转移【3,4】,因此,本研究将肿瘤细胞周围mCherry+中性粒细胞和同组织未标记的中性粒细胞分别分选出进行比较后发现,mCherry+中性粒细胞具有更高的氧化磷酸化和活性氧化物水平,这些都更有利于肿瘤细胞的生长和增值。除了免疫细胞(CD45+)变化外,肿瘤转移过程中的其他类型细胞也得到了比较和分析。为了更好的研究肿瘤转移发生发展这个过程中的变化,研究人员将肺转移模型分成不同的阶段,即早期肺肿瘤细胞聚集(Day5)、肺微转移形成(Day7)、晚期肺大转移灶形成(Day10)。同样的,研究人员将早期和晚期内mCherry+和mCherry-的非CD45+细胞进行单细胞测序分析发现,在肿瘤转移早期细胞,肿瘤细胞周围的其他细胞已经明显向有利于肿瘤细胞生长和转移的方向变化,比如转移灶内mCherry+细胞高表达WNT1-induced protein (ISP1),同时,GSEA信号通路分析发现mCherry+细胞内有大量肺上皮细胞相关信号通路发生变化,且微转移灶主要集中在肺泡部位,并高表达上皮细胞黏附蛋白标记EPCAM,这些结果预示,肺转移灶肿瘤细胞微环境内肿瘤细胞周围细胞具有上皮细胞特性。
为了更好的辨别这类细胞,研究人员进一步对这部分mCherry+上皮细胞进行分析发现,他们不但具有更强的增殖能力(Ki67+),且Epcam+细胞能够促进肿瘤细胞的生长。单细胞RNA测序分析发现,mCherry+Epcam+细胞主要分为Cdh1+和Cdh1 -(E-cadherin,上皮细胞特有标记)两种细胞群,其中mCherry+Epcam+Cdh1+细胞和未标记远端肺Epcam+细胞表达有相同的肺泡基因,相反的,mCherry+Epcam+Cdh1-细胞则大量表达前提细胞基因Ly6a和Tm4sf1,并低表达肺泡细胞相关标志物。由此证明了肺转移灶内存在一群去分化的上皮细胞,在这里,作者将他们定义为肿瘤相关实质细胞(cancer-associated parenchymal cells, CAPs)。
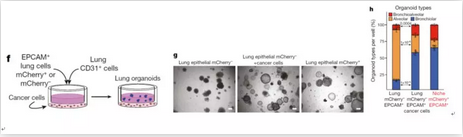
接下来,研究人员从功能上对CAPs这类细胞进行了研究。通过使用3D类器官共培养技术,发现了和CD31+细胞共培养后,和未标记的Epcam+细胞主要生成的肺泡型(alveolar)类器官不同,CAPs(mCherry+Epcam+)细胞更倾向于生成具有多谱系的支气管肺泡型(bronchioalveolar)类器官。类似的,在肿瘤细胞的刺激下,Epcam-细胞也可被诱导成为CAPs细胞,并生成支气管肺泡型类器官。通过进一步对谱系标记(Sftpc-CreERT2 lineage cells)的上皮细胞AT2 (alveolar type II cells)进行同样试验后发现,这些细胞在肿瘤细胞刺激下也能够生成支气管肺泡型类器官,由此证明了CAPs来源于激活的AT2细胞。
总的说来,本研究开发了一种mCherry标记微环境系统,并验证了这个系统在辨别肿瘤细胞周围环境细胞组成和功能等研究方面的有效应用,为研究肿瘤转移微环境研究提供了有力武器。通过使用这种方法,在乳腺癌肺转移灶内发现了一类来源于AT2细胞的CAPs,这类细胞具有干细胞特性,不但能够自我更新和大量增值,同时具有去分化特性和多分化的潜能,进而促进肿瘤细胞增值和转移。
原文链接:
https://doi.org/10.1038/s41586-019-1487-6
制版人:小娴子
参考文献
[1]Hanahan, D. & Coussens, L. M. Accessories to the crime: functions of cellsrecruited to the tumor microenvironment. Cancer Cell 21, 309–322 (2012).
[2] Quail,D. F. & Joyce, J. A. Microenvironmental regulation of tumor progression andmetastasis. Nat. Med. 19, 1423–1437 (2013).
[3] Wculek, S. K. & Malanchi, I. Neutrophilssupport lung colonization of metastasis initiating breast cancer cells. Nature528, 413–417 (2015).
[4] Coffelt, S. B., Wellenstein, M. D. & deVisser, K. E. Neutrophils in cancer: neutral no more. Nat. Rev. Cancer 16,431–446 (2016).