国家药监局2022年报告,共批准55个创新医疗器械
近日,国家药监局发布《2022年度医疗器械注册工作报告》(以下简称《报告》)。《报告》显示,2022年,高端医疗装备国产化有新突破,国家药监局共批准55个创新医疗器械产品上市,比2021年增加57.1%。
《报告》指出,2022年,国家药监局根据疫情防控形势和要求的变化,全力做好新冠病毒抗原检测试剂优先审评审批工作,新批准47个新冠病毒抗原检测试剂,延长已获批新冠抗原检测试剂注册证有效期,充分满足疫情防控需要。国家药监局还启动了新冠病毒核酸采样设备应急审批,组织修订《医用外科口罩》《一次性使用医用口罩》行业标准,全程指导注册申请人做好体外膜肺氧合(ECMO)产品注册研发,推动产品尽快上市。
《报告》称,去年,国家药监局按程序做好创新医疗器械、临床急需医疗器械审评审批,高端医疗装备国产化有新突破,批准首个国产质子治疗系统等创新医疗器械55个(总数为189个),优先审批医疗器械77个(总数为126个),创新医疗器械获批数量与2021年相比增加57.1%,更好地满足人民群众使用高水平医疗器械需要。
同时,工信部、国家药监局联合印发人工智能医疗器械创新任务揭榜入围单位名单,启动生物医用材料创新任务揭榜挂帅工作,进一步激发产业发展活力。此外,国家药监局落实国家重大区域发展战略要求,印发港澳医疗器械注册人在粤港澳大湾区内地9市生产医疗器械实施方案,进一步推动区域产业发展。牵头组织推进海南博鳌乐城国际医疗旅游先行区临床真实世界数据应用试点工作,批准热蒸汽治疗设备及一次性使用前列腺热蒸汽治疗器械4个试点品种上市,指导召开了首届博鳌药械真实世界研究大会,真实世界数据应用和研究取得新突破。
《报告》还显示,2022年,国家药监局修订发布《关于第一类医疗器械备案有关事项的公告》,加强备案工作培训指导,完成全部冷敷贴、冷敷凝胶产品备案清理,及时纠正显微针、口鼻气雾给药器等备案不规范行为。国家药监局还会同国家卫健委修订发布《医疗器械临床试验质量管理规范》(GCP),进一步规范临床试验过程,确保临床试验结果真实、准确、完整和可追溯。开展2022年度医疗器械临床试验监督检查(包括临床试验产品的真实性核查)。发布《医疗器械注册质量管理体系核查指南》,提高医疗器械注册人制度下医疗器械注册质量管理体系核查工作质量。
根据《报告》,去年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请共计10571项,与2021年相比减少13.7%。这一年,国家药监局共批准医疗器械首次注册、延续注册和变更注册11942项,与2021年相比注册批准总数量增长5.5%。其中,首次注册2500项,与2021年相比增加46.2%;延续注册5218项,与2021年相比减少24.8%;变更注册4224项,与2021年相比增加58.5%。2022年,企业自行撤回首次注册申请、自行注销注册证书214项。
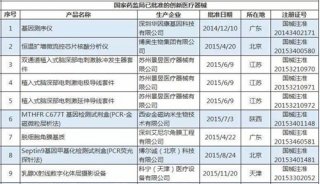
《报告》指出,2022年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请343项,比2021年增加37.8%,其中68项获准进入创新医疗器械特别审查程序。从2014年至2022年,国家药监局共批准189个创新医疗器械。其中,境内创新医疗器械涉及15个省的134家企业,进口创新医疗器械涉及2个国家的8个企业。北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的189个创新医疗器械的82.5%。
-
焦点事件

-
焦点事件

-
标准
-
焦点事件

-
政策法规

-
焦点事件

-
政策法规
-
焦点事件

-
招标采购
-
焦点事件

-
焦点事件