《Cell》子刊揭示肿瘤干细胞如何驱动肿瘤发展
目前对于癌症干细胞样细胞(CSCs)如何与其更受限制的后代相互作用知之甚少。
在过去的十年中,越来越多的证据表明,某些肿瘤与其起源组织相似的谱系管控,这些谱系最顶端的细胞群由肿瘤干细胞样细胞(CSCs)组成。致瘤过程的多种特征与组织正常发育和再生过程相似:CSCs的可塑性和异质性以及它们在特定组织的定位与其正常对应物的定位非常相似。
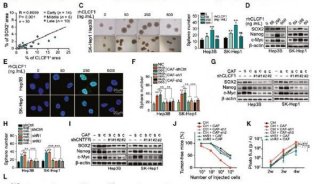
在胶质母细胞瘤(GBM)中,脑肿瘤干细胞和其他致死性的神经胶质瘤干细胞样细胞(GSC)的存在仍存在大量争议。最有力的证据谱系模型来自基因修饰的小鼠肿瘤。在人脑胶质瘤中,有不同的细胞亚群,其具备形成作为异种移植物肿瘤高增殖能力,并且在克隆培养中形成其特征性球体,这些球体被称为神经球或神经胶质瘤球。这些研究背景似乎概括了原始肿瘤的细胞异质性,表明它们具有自我更新能力和部分分化成相应谱系的能力。
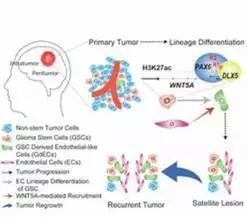
肿瘤干细胞与其谱系
虽然GSCs是否存在于所有人类GBM中仍不清楚,但来自多个实验室的研究认为至少有一些GBM与GSCs一起组织形成具有层次的结构,产生分化性神经胶质瘤细胞(DGC)。一些高通量测序研究揭示了该谱系中的高度复杂性,因为单一肿瘤可能含有多种GSCs,具有不同的遗传和分子表达谱。
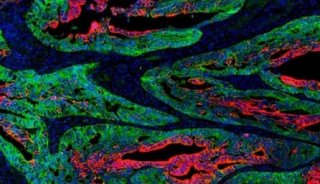
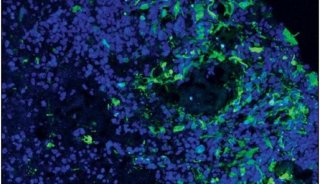
然而,所有的GSCs具有共同的特征,因为它们对大多数治疗策略具有相对抗性,并且可以在标准治疗之后重新生成肿瘤,这些标准治疗本身是靶向DGC。一些GSCs存在于血管周围的肿瘤边缘处,而其他GSCs可能位于肿瘤中心,血管化程度较低,但相对缺氧程度较高。多种细胞类型包括血管成分,免疫细胞,神经胶质和神经元构成了这些GSC细胞基团。
Wang等人在本期“Cell Stem Cell”中发表了新的研究成果,证明DGCs通过为GSCs提供营养环境,而不仅仅作为其细胞伴侣。在这种复杂的肿瘤生长发育过程中中发挥重要作用。他们发现DGCs分泌脑源性神经营养因子(BDNF)和GSCs表达该神经营养因子的同源神经营养受体激酶2(NTRK2),也称为TRKB。
长期以来,BDNF被认为是一种神经营养因子,主要通过自分泌和旁分泌信号机制促进神经元的存活,增殖和分化。然而,最近,在多能神经干细胞和祖细胞受体以及神经胶质瘤中发现了BDNF的其他作用。
根据神经祖细胞的研究,研究人员发现BDNFNTRK2信号通过激活AKT途径来促进GSCs的生长和存活。他们还发现BDNF以自分泌的方式促进DGC的增殖。重要的是,他们发现,DGCs对BDNF产生的抑制阻断了它们的肿瘤促进作用。
本研究中发现GSCs本身通过DGCs调节BDNF的产生来诱导VGF的产生。。研究结果显示BDNF诱导GSCs分泌VGF,促进了DGC在反馈调节环中的存活和BDNF的分泌。这种监管反馈循环机制和分化后代与其亲代干细胞或祖细胞之间的双向信号传导对器官发育和组织再生至关重要。
目前的研究结果表明,GSC也依赖于来自DGC的信号来维持其生存并促进GBM中的肿瘤生长。该研究还明确了一个潜在的治疗靶点:通过抑制BDNF-NTRK-AKTVGF轴破坏DGC-GSC相互作用。此为肿瘤早期诊治提供了新的思路。
-
科技前沿
-
项目成果
-
项目成果

-
项目成果