罗氏肿瘤免疫疗法Tecentriq+化疗方案审查遭美国FDA延长

瑞士制药巨头罗氏(Roche)旗下基因泰克近日宣布,美国食品和药物管理局(FDA)已将PD-L1肿瘤免疫疗法Tecentriq(atezolizumab)一份补充生物制品许可申请(sBLA)的审查时间延长3个月。该sBLA申请批准Tecentriq联合化疗药物Abraxane(Nab-Paclitaxel,白蛋白结合型紫杉醇)和卡铂一线治疗EGFR和ALK基因没有任何突变的转移性非鳞状非小细胞肺癌(NSq NSCLC)患者。
此次延长审查,将使FDA有时间来审查与支持sBLA相关的额外信息。FDA预计将在2019年12月2日作出最终审查决定。
此次sBLA是基于多中心、随机、开放标签III期研究IMPOWER130(NCT02367781)的数据。研究共入了724例化疗初治IV期非小细胞肺癌患者,这些患者未接受任何疗法治疗转移性疾病。这些患者以2:1的比例随机分为2组:A组(Tecentriq+Abraxane+卡铂,n=483例)和B组(Abraxane+卡铂,n=241例)。
A组:在诱导治疗期,患者接受Tecentriq(每个周期的第1天给药,每21天为一个周期)、卡铂(每个周期的第1天给药,每21天为一个周期)、Abraxane(每个周期的第1、8、15天给药,每21天为一个周期)治疗4-6个周期或直至临床受益丢失,无论哪个先发生;在维持治疗期,患者接受Tecentriq维持治疗。
B组:在诱导治疗期,患者接受卡铂(每个周期的第1天给药,每21天为一个周期)、Abraxane(每个周期的第1、8、15天给药,每21天为一个周期)治疗4-6个周期或直至临床受益丢失,无论哪个先发生;在维持治疗期,患者接受最佳支持护理。维持治疗时,患者可以转换为Alimta(培美曲赛),在第5版方案批准之前获得同意的患者还将有权选择交叉接受Tecentriq单药治疗,直至病情进展。
该研究的目的是确定Tecentriq是否改善了患者的总生存期(OS)以及无进展生存期(PFS),次要终点包括总缓解率(ORR)、缓解持续时间(DOR)和不良事件。
结果显示,该研究达到了2个主要目标:与化疗组相比,Tecentriq+化疗治疗组中位OS显著延长(18.6个月 vs 13.9个月)、疾病进展或死亡风险降低36%。该研究中,联合治疗的安全性数据与每个单独组分已知的安全性一致。接受Tecentriq联合治疗的患者中,有73.2%的患者经历了严重或危及生命的不良事件,化疗组为60.3%。

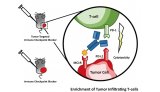
Tecentriq属于PD-(L)1肿瘤免疫疗法,靶向结合肿瘤细胞和肿瘤浸润免疫细胞上表达的PD-L1蛋白,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,Tecentriq可以激活T细胞。
截至目前,Tecentriq已获多个国家批准作为单药疗法及联合靶向疗法和/或化疗,治疗多种类型的非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)、某些类型的转移性尿路上皮癌(mUC)、PD-L1阳性三阴性乳腺癌(TNBC)。
-
焦点事件
-
项目成果
-
产品技术

-
产品技术












