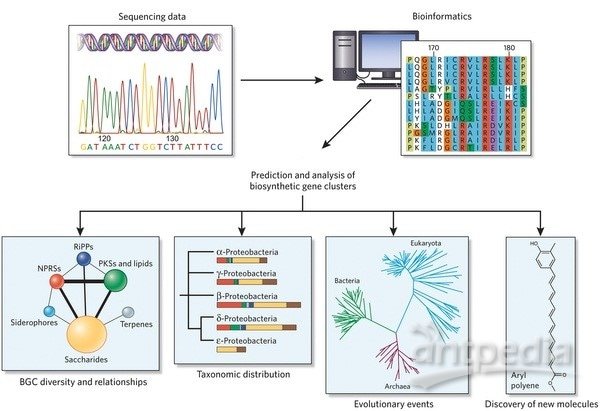
蛋白质的复性
蛋白质的复性
蛋白质复性的最大问题,是在复性过程中形成中间体和多聚体,中间体阻碍作用大的使蛋白质正确折叠困难,复性就困难;阻碍小或无阻碍的容易复性。降低蛋白浓度可以减少中间体形成提高复性率。减少中间体的形成,可选用添加小分子物质,又叫分子伴侣,如精氨酸、甘油、PEG等小分子物质帮助蛋白质正确折叠。避免多聚体的形成入氧化还原剂(DTT、szlig;-ME、还原型谷胱甘肽、氧化型谷胱甘肽、Cu2+等),帮助蛋白质复性中二硫键的正确配对,减少错配率。
复性缓冲液的pH要远离等电点,离子强度不易过高,10-50mmol/L,离子强度太高蛋白质易发生沉淀,也不利于离子交换层析的分离;复性液温度不易过高在4℃-10℃较合适对于耐热蛋白也可以室温复性。复性时间,以天然表达的重组蛋白复性应在6hr以上,需要进行酶切的融和表达重组蛋白,至少要复性1hr以上,方可进行进一步的酶切。
复性方式:常用的有透析复性和稀释复性。透析复性适用于小样品制备;对于大样品制备,采用稀释复性法简便、实用。一般包含体蛋白的复性浓度不易过大,不同的蛋白质有所区别,一般掌握在100-200ug/ml较合适,蛋白浓度太稀使纯化流程过长,蛋白浓度太浓,蛋白质复性不完全,会直接影响蛋白的回收率。直接稀释有困难的,也可以试用分段稀释法。
蛋白质的复性是重组蛋白纯化中最关键和最复杂的问题。蛋白质的性质不同,所处的环境不同,使其复性条件大不相同。任何一个蛋白质都有一个最佳的复性条件,这个最佳条件的选择是靠大量的实验来完成的。只有选择到了合适的复性缓冲液,使蛋白得以正确折叠,才能使进一步的层析分离得以顺利完成。