跨越百年的“魔法炸弹”抗体偶联药物
医学史上,总有眼光超越时代的伟人,他们的那些神奇脑电波,可能足以指导几十年,甚至上百年后的治疗突破、药物开发。
比如1908年的诺奖得主保罗·埃尔利希(Paul Ehrlich),他能从不同细胞被染料着色的差异,想到用化学物质杀伤病原体,这是癌症化疗最早的理论基础。第一种化疗药出现,是四十多年后的事情了,他这是超前了几个时代?

埃尔利希绝对是大神,24K纯度的
(图片来源:Wikipedia)
因此,埃尔利希被后人称为“化疗之父”,但他的超前理念,可不止这一个。
著名的“魔法子弹”(Magic Bullet)理论,同样是埃尔利希提出的,他认为可以针对病原体特殊的结构特点,寻找和研制只杀伤病原体,不影响正常组织和细胞的药物[1]。这理论,说的不就是今天百花齐放的抗癌靶向药嘛。
说到靶向药,懂行的人自然就会想到单克隆抗体,而“抗体”这个词,也是在埃尔利希1891年发表的论文当中首次出现的,意不意外?大神的脑洞就是厉害。
埃尔利希认为,假如把化疗药物连接到抗体上,就能提高治疗的选择性和效果。等一下,这怎么听着好耳熟?抗体、化疗、连接——原来抗体偶联药物(Antibody-Drug Conjugate,ADC),也是您老人家最早畅想出的东西啊!

大道若简,抗体偶联药物的组成也不那么玄乎
(图片来源:iGEM.org)
然而埃尔利希提出理论依据的整整一百年后,第一种抗体偶联药物才姗姗来迟,可真是让人好等啊。这位千呼万唤才始出来的ADC,身上有怎样的魔力呢?
“1+1+1”,癌细胞的精准催命符
智慧简单,又不简单。至少抗体偶联药物的组成,并不那么复杂:把细胞毒性药物通过化学链接,偶联到靶向癌细胞表面特定位点的单克隆抗体上,选择性强的魔法子弹,就被制成了。
很显然,抗体偶联药物的给药不仅比普通化疗更精准,而且抗体结合靶点,能使药物被癌细胞直接通过胞吞作用,“吃进”细胞里。化疗药搞内部爆破,肯定杀伤力更强啊,对癌细胞来说简直就是东风快递上门了。
被吞进癌细胞里的化疗药,就像是特洛伊木马杀出的伏兵,在杀伤癌细胞之后,还可能有余力冲出去,继续对周围的癌细胞造成杀伤。这种旁杀伤效应(Bystander Killing),同样是抗体偶联药物的起效机制之一。
而抗体在这个过程中,也并不是搭载完药物,就开始吃爆米花看戏了。如果被选用的单克隆抗体本身就有不错的抗癌效果,比如曲妥珠单抗这样的成功案例,那细胞毒性药物和单抗,就能对癌细胞一起进行杀伤了[2]。
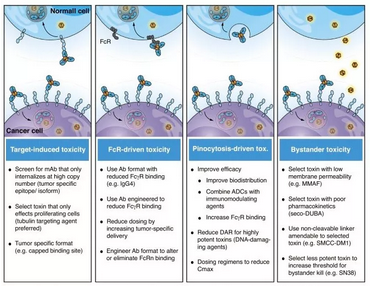
其实细化说,抗体偶联药物一共有上面这四种杀伤机制
(图片来源:Current Opinion in Immunology)
只看理论的话,抗体偶联药物能够实现“比化疗更精准,比靶向更强力”,在疗效上实现进步的同时,还降低了副作用。但在理论转化到现实的过程中,抗体偶联药物的设计和制备,却要面对不少的技术难关。
比如说,怎么才能保证抗体上搭载的药物,在进入人体的血液循环后保持稳定,直到遇见癌细胞才被释放?要是药物不稳定,提前脱落了,可就是走一路害一路了。这就对连接药物和抗体的偶联技术,提出了很高的要求。
而选择单抗和细胞毒性药物背后,也有不少的学问。单抗要有选择性,而化疗药的杀伤力要强、稳定性要高,还能在结构上具备化学偶联的基础,得好好挑一挑才能找到合适的搭档。随便拉郎配,可是绝对嫁不对郎的。

把理论效果真正实现,需要药物设计上的高水平
(图片来源:Journal of National Cancer Institute)
高标准严要求之下设计出的ADC,才能真正体现价值。2000年获批的第一种抗体偶联药物吉姆单抗/奥佐米星(Gemtuzumab Ozogamicin),就因为技术问题,疗效不够副作用也高,遭遇了退市的尴尬。
吉姆单抗/奥佐米星的挫折,其实算是抗体偶联药物百年发展史的缩影吧。
我来,我见,我征服
现实里的科学家,可没有魔杖一挥,凭空变出东西的本事。就算是哈利波特,上魔药课也得老老实实准备原料啊。抗体偶联药物想要现身江湖,就得等抗体和药物齐备了才行。
所以保罗·埃尔利希提出的“药物连接抗体”设想,在半个世纪里都无人问津,直到1957年,法国免疫学家Georges Mathé才第一次进行了实验性的尝试,他把甲氨蝶呤连接到免疫球蛋白上,用来治疗白血病[3]。
但初步探索的成果,却难以从实验室转化到临床。实验室里用的免疫球蛋白是动物来源,总不能把这个直接用到人身上吧?再说还有提纯和制备的难题。因此Georges Mathé的探索并没有持续多久,其它科学家的后续研究也相继卡壳了。

一直觉得各种抗体和免疫球蛋白特有美感
(图片来源:维基百科)
好在这种停滞并不算久。1975年,单克隆抗体技术横空出世,再加上十年后抗体人源化技术的诞生,一举解决了抗体制备和提纯问题。HER2这样的靶向治疗位点被发现,让“寻找病原体特殊结构”也成了现实。
而在抗体技术进步的同时,偶联也在不断进化,尤其是细胞生物学上对胞吞作用和溶酶体的理解,让偶联的效率和稳定性,超越了Georges Mathé时代简单化学反应的效果,也让癌细胞胞吞进化疗药,“自取灭亡”成为了可能。
这一系列的条件成熟,让抗体偶联药物的研发在20世纪90年代开始起飞。虽然被FDA加速审批上市,用于急性髓细胞白血病治疗的吉姆单抗/奥佐米星遭遇退市,但这一盆冷水,没有彻底浇灭抗体偶联药物的火苗。
2011年,本妥昔单抗(Brentuximab vedotin)获批上市,标志着以偶联技术进步为特点的第二代抗体偶联药物成熟,而2013年恩美曲妥珠单抗(Trastuzumab emtansine/T-DM1)的获批,则是抗体偶联药物向实体癌症发起挑战的开始。

这张图,算是T-DM1的真容吧
(配图来源:Roche)
那么走到今天,抗体偶联药物又取得了哪些新突破呢?
既要行好事,也要问前程
算上2017年重装上阵的吉姆单抗/奥佐米星,FDA目前正式批准的抗体偶联药物已经有5种,聚齐了老中青三代,一般认为在本妥昔单抗和T-DM1之后的新型药物,可以被划入第三代抗体偶联药物的范畴。
不过这5种药物,有4种针对的是血液系统癌症,只有T-DM1可以用于实体肿瘤的治疗。看药品名就能看出,T-DM1是在传奇的曲妥珠单抗基础上改造而来,因此最早探索的也是HER2乳腺癌的治疗。
在取得了转移性患者二线治疗的成功后,T-DM1就转向了辅助治疗的战场,帮助老大哥曲妥珠单抗解决一个棘手的临床难题:靶向HER2的新辅助治疗后,仍存在残余肿瘤的患者。这些患者在手术后5年内,癌症复发的风险可是相当高。
KATHERINE试验的结果显示,T-DM1的使用,使这些患者3年内的无浸润性疾病生存率达到88%,比曲妥珠单抗单独治疗的复发风险,相对下降了50%。这突破性的提升幅度,当年曲妥珠单抗在辅助治疗时对比化疗,也不过如此吧[4-5]。
而且,随着抗体偶联药物的使用经验增多,意外之喜也层出不穷。就拿T-DM1来说,它能在杀伤癌细胞的同时,有效激活T细胞介导的抗肿瘤免疫应答,从而为它和免疫治疗的联合使用提供了证据[6],相关的早期临床试验已经启动了。

在HER2乳腺癌上,免疫治疗联合靶向药前景确实值得期待
(图片来源:哈佛大学)
话说回来,PD-1/L1抑制剂们不都是单克隆抗体吗?在它们的基础上加挂细胞毒性药物弹头,会不会让疗效进一步升级[7]?免疫与化疗的联合,成功经验可不少。据说英国科学家已经设计出新的PD-1抗体,专门用来开发抗体偶联药物了。
癌症之外,抗体偶联药物还有许多的可能,比如风湿病和自身免疫病的治疗,在不断涌现的单抗新药基础上,改造出新型药物也很有可行性。第一种专门用于类风湿关节炎治疗的抗体偶联药物,已经在2019年初进入了临床试验阶段。
再说了,抗体偶联药物的研发,目前本来就是未知远远大于已知的领域。现有药物的成功,并不意味着疗效和设计达到了最优化,比如偶联技术和抗体选择的升级,几乎是以日新月异的速度在前进,可以说,每个药物都有特殊之处。
不过尝试全新的领域,也需要成熟智慧的结晶,技术壁垒不是说着玩的。这种时候就得看看玩单抗的大行家,比如已经有两种获批ADC的基因泰克,竟然能搞出单克隆抗体+抗生素的ADC创意。虽然还是早期研发,但这个脑洞真够厉害。
方兴未艾的抗体偶联药物,未来还能绽放出怎样的精彩?最近站在曲妥珠单抗巨人肩膀上,成果登上顶级期刊的几个新星[8-9],真是吊足了奇点糕的胃口。未来是你们的,大胆去闯吧。







