人体基因治疗的递送途径
与小分子药物不同,大多数基因治疗的分子无法通过自由扩散越过生理屏障进入细胞内部,且面临在血液循环中被降解的问题,因此,递送问题一直以来都是困扰基因治疗临床应用的主要障碍。经过多年的发展,科学家已发展出包括病毒载体、非病毒载体、细胞递送等多种用于人体基因治疗的递送途径。
直接递送
在早期的研究中,科研人员经常使用直接递送的方式,外加下肢静脉加压、电穿孔等手段在小鼠等动物模型上开展基因治疗的实验,但这些尝试仅限于验证基因治疗的原理,很难真正应用在人体中。目前只有反义寡核苷酸类基因疗法仍多使用直接递送(注射),这是因为与其他基因治疗相比,反义寡核苷酸分子量相对较低,且经过化学修饰后较不易被血液中的核酸酶降解,进入血液循环后可以广泛分布于各组织中。
病毒基因载体
病毒感染细胞的过程即是一个将自身携带的遗传物质运载入宿主细胞的过程,因此病毒是天然的基因载体。在基因治疗相关的研究中,使用较多的有逆转录病毒、慢病毒、腺病毒、腺相关病毒、单纯疱疹病毒等。
逆转录病毒(Retrovirus)是一种以RNA为遗传物质的病毒,当病毒感染细胞后,RNA经逆转录酶合成双链DNA,双链DNA可以被整合到宿主细胞自身的基因组中,并随宿主细胞分裂传递给子代细胞。使用逆转录病毒做为基因载体可以高效转染分裂旺盛的细胞,但其转染分裂静止的细胞能力较差。慢病毒(Lentivirus)是逆转录病毒科下属的一种病毒,它可以转染分裂静止的细胞。由于逆转录病毒和慢病毒具备随机的整合基因到宿主细胞中的能力,使用这一类病毒作为基因载体可产生永久性的基因改变。另外,如果基因在宿主细胞中插入的位置不适当,则有可能造成癌症等严重后果。例如,一项使用逆转录病毒载体治疗先天性免疫缺陷症的临床试验,在几年后导致患者得上了白血病。
腺病毒载体(Adenovirus)是另一种常见的病毒载体。相比于逆转录病毒载体,腺病毒载体将基因整合到宿主细胞的能力很弱,因此致癌致突变风险较低。腺病毒在分裂旺盛和分裂静止的细胞中均可复制,应用范围非常广泛。另外腺病毒载体包装容量大,可以用于转染较大的基因片段。但腺病毒载体免疫原性较高,较易发生过敏等不良反应。第一例基因治疗导致的死亡病例即是由于腺病毒载体造成的严重过敏反应所致。
腺相关病毒(Adeno-Associated Virus, AAV)是一种单链DNA病毒,该病毒无法自我复制,但可以转染分裂旺盛或分裂静止的细胞,并将基因组整合至人19号染色体的一段固定区域中。由于该区域固定且功能已知,腺相关病毒致癌风险较低。与腺病毒相比,腺相关病毒的免疫原性也大大减弱,较少出现不良反应。然而,腺相关病毒包装容量较小,且生产较为复杂,这一定程度上限制了它的广泛应用。
单纯疱疹病毒(Herpes Simplex Virus, HSV)是一类双链DNA病毒,由于其对神经细胞具有天然的亲嗜性,被用于神经系统的基因治疗中。HSV载体具有包装容量大、能感染静止期细胞、不整合入宿主细胞基因组等一系列优点。然而,HSV对大多数细胞毒性较大,转染后表达时间较短,因此HSV较少用于其他基因治疗中。
非病毒基因载体
由于病毒载体存在着诸如易整合入宿主细胞基因组、免疫原性、毒性等问题,近年来,研究人员尝试用一些人工合成的化学物质模拟病毒包装DNA/RNA的过程,以作为取代病毒载体的非病毒基因载体。非病毒基因载体尺寸大多在10到100 nm左右,进入血液循环后,它可利用毛细血管上的窗口被动靶向至特定器官或组织(见“高渗透长滞留效应”),然后借助胞吞/胞饮作用进入细胞内部,利用材料本身的特性诱导溶酶体破裂,最终将携带的DNA/RNA释放到细胞中。
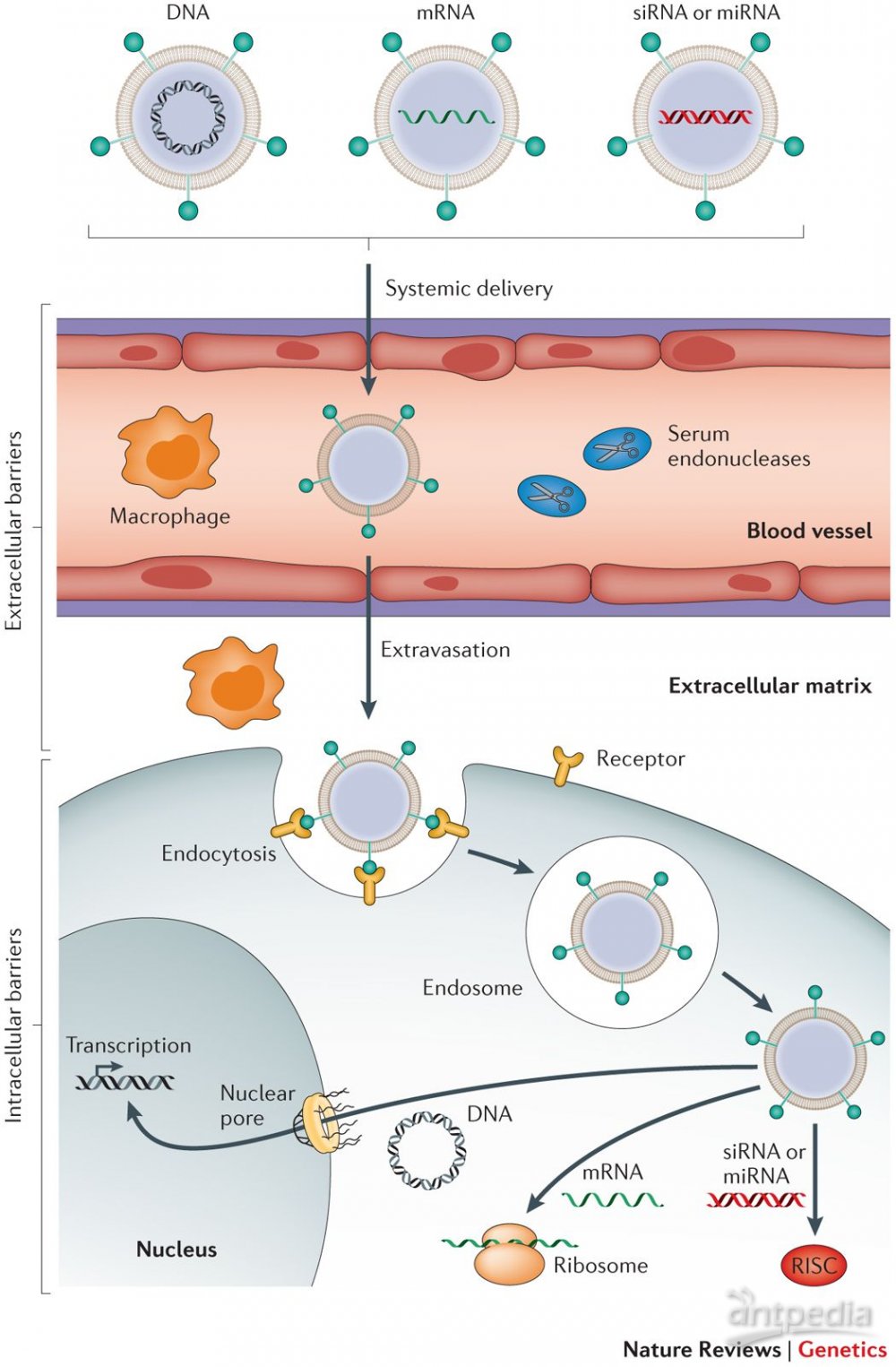
非病毒基因载体进入细胞的过程
非病毒基因载体按化学成分可大致分为脂质体、有机高分子聚合物和无机纳米材料这几类。脂质体(Liposome)是最早被用于基因治疗研究的非病毒载体,它是一种由磷脂分子(多为阳离子磷脂)组成的小球,内部包裹需要递送的DNA/RNA。由于和细胞膜成分接近,脂质体可以与细胞膜发生融合,并释放需要递送的材料。第一种获得FDA批准的siRNA药物Patisiran即是使用脂质纳米颗粒递送的。
有机高分子聚合物(主要是阳离子聚合物)亦可以通过静电相互作用压缩DNA/RNA并递送至细胞中。相比于脂质体,高分子聚合物在环境中更稳定,结构也更丰富多样。另外,还可以通过化学反应在高分子材料上引入可以靶向至特定组织或器官的分子,也可以同时将小分子药物和基因递送至细胞内以实现协同作用。不过,阳离子聚合物常常存在转染效率和毒性无法兼容的问题,加之许多聚合物在体内降解困难,很多聚合物材料的毒性(尤其是累积毒性)并未完全被掌握,截至2019年底,尚未有使用有机高分子聚合物载体的基因治疗药物获得FDA批准。
无机纳米材料是另一类探索中的非病毒基因载体。相比于有机高分子聚合物,无机纳米材料的形貌较为容易控制,因此经常作为模型用来研究不同尺寸或形貌的载体对递送效率的影响。但无机纳米材料亦存在体内降解困难等瓶颈,目前大多数无机纳米载体仍处于实验室阶段。
通过细胞递送
一种可以绕开递送过程中生理屏障的办法是在体外转染特定的细胞,然后再将已转染的细胞输入患者体内。这种思路非常适合血液系统疾病的基因治疗。由于体外转染远比体内转染简单高效,用于体外基因转染的工具也可以有更多选项,例如CRISPR等新一代基因编辑工具。通过细胞递送的另一个优势是可以更好地监测基因转染的效率和准确性,因为转染后的细胞可以使用流式细胞仪、RT-PCR等手段完成质量控制后再输入人体内。
目前临床上获得批准的通过细胞递送的基因治疗主要包括嵌合抗原受体T细胞(Chimeric antigen receptor T cell, CAR-T)疗法和造血干细胞基因疗法。在CAR-T细胞疗法中,首先将识别肿瘤相关抗原的序列和负责活化T细胞的胞内信号域序列在体外进行基因重组,然后在体外转染从患者身上分离的T细胞,经体外扩增后,再将这些可以识别和攻击肿瘤的工程T细胞输回患者体内。截至2019年已有两种CAR-T细胞疗法获得美国FDA批准,用于治疗急性淋巴细胞白血病和弥漫性大B细胞淋巴癌(见“添加式基因疗法”一节)。与CAR-T细胞类似,在造血干细胞基因疗法中,首先从患者身上分离自体造血干细胞,在体外转入治疗性基因后,经体外扩增再输回患者体内。造血干细胞基因疗法本质上相当于在体外纠正自体干细胞的基因缺陷,同时避免了异基因骨髓移植带来的排异风险。截至2019年底亦有两种造血干细胞基因治疗获得欧洲EMA批准,分别用于治疗ADA-SCID和β-地中海贫血(见“添加式基因疗法”一节)。