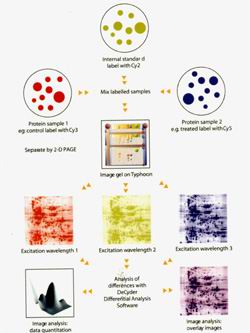
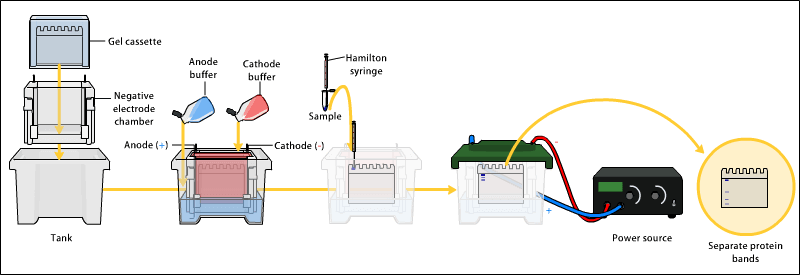
sds-page凝胶电泳怎么制备
SDS-PAGE电泳可用于分离蛋白质和核苷酸
,这里综述了SDS-PAGE实验原理、试剂和器材、以及实验操作步骤。
一.
实验原理:
SDS-PAGE是对蛋白质进行量化,比较及特性鉴定的一种经济、快速、而且可重复的方法。该法是依据混合蛋白的分子
量不同来进行分离的。
SDS是一种去垢剂,可与蛋白质的疏水部分相结合,破坏其折叠结构,并使其广泛存在于一个广泛均一的溶液中。SDS蛋白质复合物的长度与其分子
量成正比。在样品介质和凝胶中加入强还原剂和去污剂后,电荷因素可被忽略。蛋白亚基的迁移率取决于亚基分子量。
二.
试剂和器材:
试剂:1.
5x样品缓冲液(10ml):0.6ml
1mol/L的Tris-HCl(pH6.8),5ml
50%甘油,2ml
10%的SDS,0.5ml巯基乙醇,1ml
1%溴酚蓝,0.9ml蒸馏水。可在4℃保存数周,或在-20℃保存数月。
2.
凝胶贮液:在通风橱中,称取丙烯酰胺30g,甲叉双丙烯酰胺0.8g,加重蒸水溶解后,定容到100ml。过滤后置棕色瓶中,4℃保存,一般可放置1个月。
3.
pH8.9分离胶缓冲液:
Tris
36.3g
,加1mol/L
HCl
48ml,加重蒸水80ml使其溶解,调pH8.9,定容至100ml,
4℃保存。
4.
pH6.7浓缩胶缓冲液:
Tris
5.98g
,加1mol/L
HCl
48ml,加重蒸水80ml使其溶解,调pH6.7,定容至100ml,
4℃保存。
5.
TEMED(四乙基乙二胺)原液
6.10%过硫酸铵(用重蒸水新鲜配制)
7.
pH8.3
Tris-甘氨酸电极缓冲液:称取Tris
6.0g,甘氨酸28.8g,加蒸馏水约900ml,调pH8.3后,用蒸馏水定容至1000ml。置4℃保存,临用前稀释10倍。
8.
考马斯亮蓝G250染色液:称100mg考马斯亮蓝G250,溶于200ml蒸馏水中,慢慢加入7.5ml
70%的过氯酸,最后补足水到250ml,搅拌1小时,小孔滤纸过滤。
器材:电泳仪
,电泳槽,水浴锅,摇床。
三.
实验操作;
1.
样品制备
将蛋白质样品与5X样品缓冲液(20ul+5ul)在一个eppendorf
管中混合。放入100℃加热5-10min,取上清点样。
2.
分离胶及浓缩胶的制备
①
将玻璃板、样品梳、Spacer用洗涤剂洗净,用ddH2O冲洗数次,再用乙醇擦拭,晾干;
②
将两块洗净的玻璃板之间加入Spacer,按照Bio-Rad
Mini
Ⅱ/Ⅲ说明书提示装好玻璃板;
③
按如下体积配制10%分离胶8.0
ml,混匀:ddH2O
3.0
ml;1.0
mol/LTris-HCl
pH=8.8
2.1
ml;30%
Acr-Bis
2.8
ml;10%
SDS
80
ul;10%AP
56
ul;TEMED
6
ul。
④
向玻璃板间灌制分离胶,立即覆一层重蒸水,大约20
min后胶即可聚合;
⑤
按如下体积配制6%浓缩胶3.0
ml,混匀:ddH2O
1.0
mol/LTris-HClpH=6.8
30%
Acr-Bis;2.0
ml
400
ul
600
ul;10%
SDS
10%
AP
TEMED;36ul
24ul
4ul。
⑥
将上层重蒸水倾去,滤纸吸干,灌制浓缩胶,插入样品梳;
⑦
装好电泳系统,加入电极缓冲液,上样20
μl;
⑧
稳压200V,溴酚蓝刚跑出分离胶时,停止电泳,约需45
min~1hr.
⑨
卸下胶板,剥离胶放入染色液中,室温染色1~2
hr;加入脱色液,置于80
rpm脱色摇床上,每20
min更换一次脱色液(10
ml
冰乙酸;45
ml乙醇;45
ml蒸馏水)至完全脱净。
聚丙烯酰胺凝胶具有分子筛效应,可根据蛋白亚基分子量不同将分离蛋白,SDS-PAGE电泳凝胶好坏直接关系到电泳能否成成,一般浓缩胶和分离胶的pH分别是6.7和8.9.