剪接体靶向治疗诱发三阴性乳腺癌的抗病毒免疫反应
Cell |
肿瘤转录组中有不受调控的RNA剪接的迹象,例如内含子的异常保留、典型和选择性剪接的变异【1】。很多肿瘤的特性可导致这种失调,包括实体瘤和血液恶性肿瘤中RNA剪接因子的反复突变。非剪接体相关的致癌变异,如转录因子MYC的过度活化也可导致剪接失调,导致癌症细胞对剪接体高度依赖。因此,MYC、剪接体突变和其他癌基因驱动的癌症对剪接体的药物或遗传性抑制高度敏感。目前有临床试验对小分子剪接体调节物进行临床评估,同时评估靶向剪接体治疗对三阴性乳腺癌(TNBC)等缺乏靶向治疗肿瘤的治疗效果。
虽然我们已经知道小分子剪接体调节物具有抗癌效果长达20年【2】,但是其选择性抗肿瘤活性的下游机制尚不清楚。已知剪接体调节物可诱导转录组水平的错误剪接(mis-splicing),但之前的工作都聚焦于特定基因的错误剪接导致肿瘤细胞死亡和其他与剪接扰动有关的表型。例如,细胞周期的停滞与细胞周期调控子p27、Mdm4或CDC等基因的错误剪接有关。这些研究都强调了单个错误剪接的mRNA及其编码蛋白的重要性,但同时表明不同个体的肿瘤及其转录组中错误剪接的基因具有巨大差异。这就产生一个问题,是否有更广泛的途径来调控肿瘤细胞对剪接体靶向治疗(STTs)的反应,特别是对RNA剪接表现出高度依赖性的肿瘤类型?
近日,来自贝勒医学院的Thomas F. Westbrook团队在Cell杂志上发表了一篇题为“Spliceosome-targeted therapies trigger an antiviral immune response in triple-negative breast cancer”的文章,作者发现剪接体靶向治疗(STTs)诱导产生错误剪接的RNA,其通过诱导抗病毒免疫反应,触发肿瘤细胞死亡。在MYC驱动的三阴性乳腺癌中,STTs导致肿瘤细胞质内大量积累错误剪接的mRNA,形成dsRNA。随后多个dsRNA结合蛋白识别dsRNA,诱导激活抗病毒免疫反应和外源性凋亡途径。在免疫功能完整的乳腺癌小鼠模型中,STTs不仅诱导肿瘤细胞自身的抗病毒信号,而且诱导适应性免疫信号。此外,人类原发性乳腺恶性肿瘤中RNA剪接的内在缺陷与免疫反应存在具有相关性,且与乳腺癌患者无病生存率的提高相关。

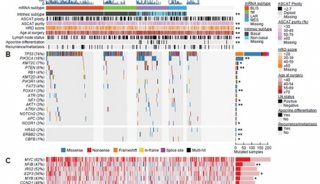
MYC驱动的癌症如TNBC对剪接体靶向治疗较为敏感,研究人员选取2种MYC驱动TNBC细胞系,用来研究剪接体抑制对其转录组的影响。结果发现,两种细胞系转录组的变化具有相关性,说明剪接体的急性抑制调控了某些共同的细胞通路。无论是小分子剪接体调节物,还是遗传突变,剪接体抑制下调细胞周期和RNA处理通路,显著上调免疫信号通路,包括IFNα和IFNβ信号,同时上调IFN刺激基因和NF -κB响应基因的表达,表明细胞启动抗病毒转录程序。值得注意的是,剪接体抑制在MYC驱动的TNBC中诱导的抗病毒转录反应远强于其在非转化型乳腺上皮细胞中的作用。研究显示,MYC过度活化和剪接体抑制可诱导抗病毒信号的强烈激活。即在MYC-驱动的TNBCs中,剪接体抑制可诱导抗病毒转录反应。正向遗传筛选和体外实验显示,敲除dsRNA感知及其下游信号通路导致癌症细胞对剪接体抑制耐受。即抑制剪接体在肿瘤细胞中诱导抗病毒信号,而这些通路可调控STTs处理下肿瘤细胞的生存。
下一步,研究人员发现剪接体抑制导致细胞质中dsRNA的显著增加,且这种dsRNA显著增加依赖于MYC过度活化和剪接体抑制的同时存在。突变剪接体组分同样导致细胞质内dsRNA的积累。那么,dsRNA的来源是什么?急性剪接体抑制导致TNBC细胞质内大量积累内含子保留的转录本,而内含子保留的mRNA形成细胞质内dsRNA,dsRNA诱导抗病毒信号的激活。那么,剪接体抑制如何诱导肿瘤细胞死亡?剪接体抑制激活下游的caspase-3、7和外源性凋亡启动蛋白caspase-8,且caspase-8的激活发生在12h内,先于caspase-3的切割。抑制外源性凋亡的启动蛋白caspase-8、10可阻断剪接体抑制对下游效应caspase的激活,而抑制内源性凋亡启动蛋白caspase-9则不能,同时坏死途径也不参与其中。即剪接体抑制诱导乳腺癌细胞凋亡是通过外源性机制,且不依赖于死亡受体。剪接体抑制条件下,敲除几个dsRNA结合蛋白(MDA5、RIG-I、DHX9和DHX33等)都可部分抑制caspase-8及凋亡的激活;同时观测到剪接体抑制导致MAVS在线粒体膜上的聚集,敲低MAVS可部分抑制外源性凋亡,损伤抗病毒转录反应。即STTs诱导细胞质内dsRNA积累,随后激活dsRNA感知途径,如MAVS依赖性和非依赖性,随后导致抗病毒转录反应的上调,激活外源性凋亡。
dsRNA途径的抗病毒信号可通过多种机制诱导肿瘤死亡,包括细胞的自发凋亡以及通过产生细胞因子和干扰素招募适应性免疫反应。利用2208L、PyMT-M、AT3和T11等不同TNBC肿瘤模型评估剪接体抑制对免疫活性完整肿瘤的影响。剪接体抑制显著减缓2208L和PyMT-M肿瘤(敏感型肿瘤)的进展,但对AT3和T11(耐受型肿瘤)效果甚微。转录组分析显示,剪接体抑制导致所有模型中内含子保留现象,但敏感型肿瘤中内含子保留现象更加显著;仅在敏感型肿瘤中显著上调抗病毒信号的基因,同时抗病毒通路和适应性免疫通路在敏感型肿瘤中富集。即剪接体抑制诱导肿瘤中抗病毒信号和适应性免疫信号通路的上调。对TCGA中原位乳腺癌样本进行分析,发现肿瘤内含子保留(IR)程度与T细胞免疫浸润相助相关。对比IR高和低的肿瘤,发现免疫信号相关通路在IR高的肿瘤中富集,且高IR与病人的无疾病进展生存率提高有关。进一步研究发现高IR高MYC人群中富集表达的信号通路中,7/10与免疫信号相关,而高IR正常MYC中仅有1项免疫通路富集;而这个现象并未在乳腺癌扩增基因CCNE1上观察到。表明MYC和IR之间的相互作用可诱导免疫信号通路的激活。
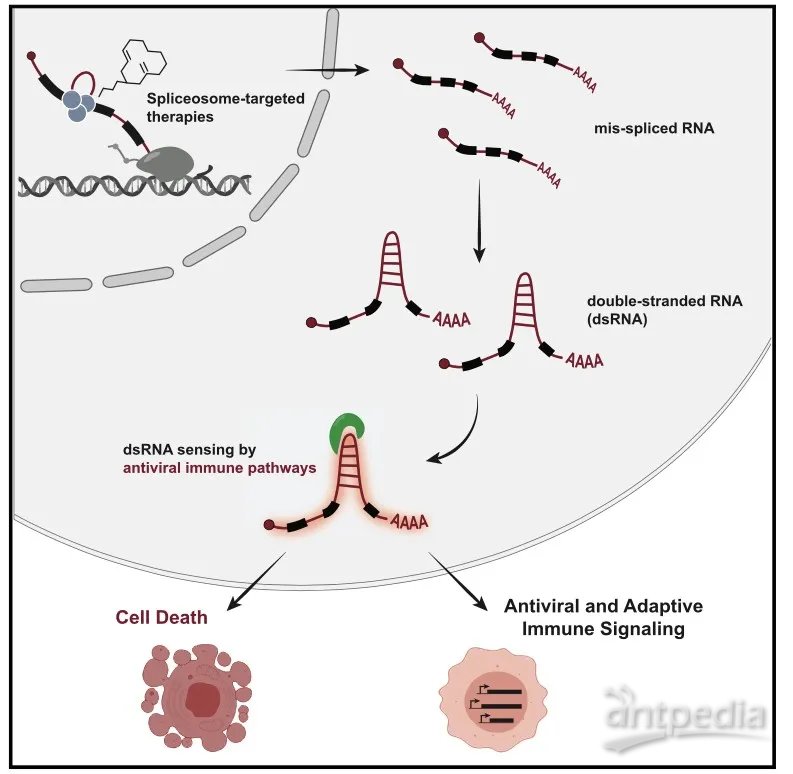
总的来说,研究揭示了剪接体靶向治疗的抗肿瘤功能的作用机制,即剪接体抑制导致肿瘤细胞质内错误剪接的RNA增多,形成dsRNA,随后激活抗病毒免疫通路和肿瘤细胞的外源性凋亡,实现抗肿瘤功能。同时揭示出MYC过度激活对剪接体靶向治疗的协同作用,研究或为剪接体靶向治疗的精准医疗提供参考。
-
项目成果