Nature子刊:周文超/卞修武/张爱丽团队发现胶质瘤等癌症治疗的潜在新靶点
胶质瘤干细胞(GSC)位于肿瘤细胞分化层级的顶端,在胶质母细胞瘤GBM的发生、发展和治疗抵抗中发挥关键作用。蛋白翻译后加工,包括蛋白构象变化和蛋白翻译后修饰,可能在肿瘤细胞的干性获得和维持中扮演重要角色。
蛋白构象变化,特别是由肽基脯氨酸顺反异构酶(PPIases)催化的蛋白异构化,在肿瘤细胞生命活动的多个方面发挥关键调节作用。Pin1是在肿瘤中研究最多的PPIase,在多种肿瘤中上调表达,已被发现超过100个底物靶蛋白,被公认为肿瘤治疗的关键药物靶点。然而Pin1高表达迄今主要被归咎于其转录调控,蛋白稳定性调控在其中的作用知之甚少。目前缺乏能够靶向Pin1蛋白表达的抗癌策略。
蛋白的SUMOylation(SUMO化修饰)是近年来备受关注的一类蛋白翻译后修饰,高度的蛋白SUMO化促进了结直肠癌、乳腺癌和脑癌等多种肿瘤发展。然而SUMO化修饰机制在正常细胞生命活动中不可或缺,关键SUMO催化酶缺失导致小鼠胚胎致死,为了避免毒副作用,需要针对SUMO化发掘更有效和安全的药物靶点。
近日,中国科学技术大学周文超课题组、卞修武院士课题组联合安徽医科大学张爱丽课题组,在 Nature Communications 期刊发表了题为:Stabilization of Pin1 by USP34 promotes Ubc9 isomerization and protein sumoylation in glioma stem cells 的研究论文。
该研究发现,Pin1蛋白在胶质瘤干细胞(GSC)中被去泛素化酶USP34稳定而高表达,且Pin1通过催化已知唯一的SUMO E2酶Ubc9来促进GSC中的全局蛋白SUMO化,并揭示了调控Pin1/USP34、Pin1/Ubc9结合的多个激酶,为靶向Pin1蛋白和全局蛋白SUMO化治疗包括胶质瘤在内的癌症提供了多个潜在药物靶点,具有十分重要的基础与转化意义。
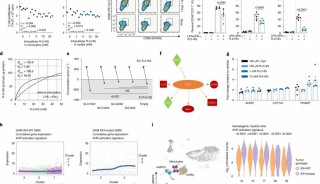
课题组前期研究中已发现Pin1在GSC中高表达且促进蛋白SUMO1型SUMO化,从而促进GSC维持和GBM发展。该研究中对Pin1上下游分子机制进行了深入探讨。研究人员使用蛋白酶体抑制剂MG132处理GSCs和对应的非干性肿瘤细胞NSTC,发现NSTC中Pin1蛋白表达显著上调至与GSCs一致水平;同时发现Pin1的泛素化水平在NSTC中显著高于GSC;推断Pin1蛋白表达受到泛素-蛋白酶体系统调控。通过免疫沉淀和蛋白质谱,在GSC中发现与Pin1蛋白结合的泛素化酶USP34;通过一系列生化实验,验证了USP34催化Pin1蛋白去泛素化而稳定,鉴定到Pin1上K117的泛素化是USP34的作用位点;发现Pin1上S65位点被Plk1激酶磷酸化而促进Pin1与USP34互作。
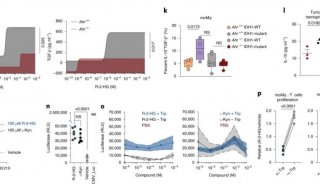
研究团队发现,与Pin1的促癌活力一致,能够促进Pin1蛋白稳定高表达的USP34同样促进GSC维持和GBM生长。另一方面,敲低USP34显著降低了Pin1介导的SUMO1型蛋白SUMO化修饰,但SUMO2/3型蛋白SUMO化修饰不受影响。通过蛋白序列分析,研究人员推断Ubc9是Pin1的靶蛋白;免疫共沉淀验证了Ubc9和Pin1结合;体外异构化实验验证了Pin1催化Ubc9蛋白异构化;进一步发现Pin1结合Ubc9的pS71-P72基序并催化其异构化,从而促进Ubc9与SUMO1基团(而非SUMO2/3基团)形成硫酯体,进而上调全局蛋白SUMO1型SUMO化修饰;Ubc9 S71位点磷酸化由CDK1激酶催化,CDK1抑制剂显著抑制Pin1与Ubc9的互作。
在治疗意义上,研究团队使用Pin1抑制剂sulfopin和CDK1抑制剂RO3306联合治疗荷瘤小鼠,有效的抑制了GSC中的SUMO1型蛋白SUMO化修饰,减缓了小鼠颅内GBM的生长,极大延长了小鼠生存期。
Pin1被USP34去泛素化后通过异构化Ubc9提高泛蛋白SUMO1型的SUMO化修饰促进GSC维持和GBM发展
综上所述,该项研究以胶质瘤干细胞(GSC)为模型,阐明了肿瘤中调控Pin1蛋白稳定性的上游机制,剖析了Pin1上调SUMO1型蛋白SUMO化的下游机制,有助于发展针对GBM和其它受Pin1驱动的恶性肿瘤的治疗新策略。