MIDASTM确证Biomarker(二)
鉴定过程共进行两次实验,约30多种蛋白质被鉴定出来,已鉴定的蛋白质如表1所示,其中红色标注的蛋白又通过MIDASTM确认。两次实验结果相比较,重叠率低于75%。许多在第一次实验中被鉴定但可信度较低的蛋白质,第二次实验中并未产生更多的MS/MS图谱,没被再次鉴定出来,增加了鉴定与验证确认的难度。例如:在第一次实验中被鉴定的蛋白质RBM17 (RNA binding motif protein 17)(表1,#24),其鉴定结果仅被一个高分值的多肽(LLQSQLQVK)所支持,并经人工分析后鉴定出来(如图4所示)。但在第二次实验中,该蛋白质并没有被再次鉴定。此例说明需要更可靠的方法来验证并确认它在样本中是否真实存在。此应用实例中,选择表1中红色标示的4个蛋白质进行MIDASTM验证,确认其是否真实存在于样本中。
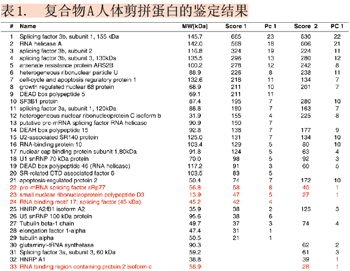
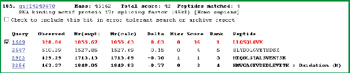
图4. 被鉴定的蛋白质RBM17,其鉴定结果仅被第一次LC-MS/MS实验的一个高分值的多肽所支持。
实验方法
样品制备
样品根据以前的方法制备[6]。简要的说,mRNA剪拼体复合物通过亲和纯化,而后通过甘油梯度离心后,样本被分离成亚复合物。这些亚复合物经过SDS-PAGE分离后,用考马斯亮蓝染色。整个样本电泳泳道用胰蛋白酶进行?位酶解后,萃取并冻干酶切产物肽段。
高效液相色谱分离
酶切产物肽段用纳升级液相色谱(LC Packing 整机系统,Dionex公司)分离。经过C18预柱脱盐后,通过C18分析柱(75mm×15cm, PepMap, Dionex)分离。分离条件:5%~40%乙腈,0.1%甲酸,流速200nl/min,60min梯度洗脱。
MIDASTM工作流程设计器
每一个需要被进一步确认的蛋白质,其胰蛋白酶酶切后的肽段作为母离子被Q1选择出来,经过Q2碎裂后,在Q3中高特异性的检测其碎片离子。只有当上述三个四级杆的扫描条件同时满足时,信号才被记录。因此,上述MRM扫描模式是LC-MS/MS在复杂体系样本中最灵敏且选择性最高的检测技术。由于每个MRM传输只需5~50ms的驻留时间(Dwell time),所以一次运行中可以同时检测多达300个分析物,大量不同的多肽可以同时被扫描检测(如图5所示)。

图5. MRM引导的MIDASTM工作流程图,所有预期的胰酶酶切蛋白质所产生的多肽通过MRM扫描模式监测,验证其是否存在,一旦信号被检测到,仪器会立刻自动切换到高灵敏度MS/MS采集,从而确认蛋白质的真实性。
胰蛋白酶酶切后的多肽与它们的碎片离子所构成的母-子离子对,可以通过MIDASTM工作流程设计器软件计算出来。根据用户输入的蛋白质序列,此软件可自动计算并构建MRM扫描模式所需的母/子离子对,且不需要合成多肽或蛋白质参照物来设计MRM扫描条件。
质谱配合MIDASTM方法检测
使用NanoSpray离子源配合4000 QTRAP
LC-MS/MS进行MIDASTM检测。
数据库检索参数
验证过程中使用MASCOT 1.9(Matrixscience Ltd.)数据库检索引擎,检索NCBInr蛋白质数据库。简要参数设置如下:MS tolerance 0.2,MS/MS tolerance 0.3,Missed cleavages 0,No variable modefications。
结果
目标蛋白质验证与确认结果
此实验中所选择的4个蛋白质,MIDASTM工作流程设计器计算得出83个母/子离子对用于分析。此83个母/子离子对在实际LC-MS/MS实验中不断地被检测到(如图6上图所示)。实验中,一旦MRM扫描出现信号,指示有多肽母离子从色谱柱中洗脱出来,质谱仪立即切换至MS/MS扫描模式(每个肽段母离子,最多采集3次MS/MS图谱数据),采集到的数据经数据库检索后,用于再次确认洗脱下来的多肽是否是来自预期的蛋白质。
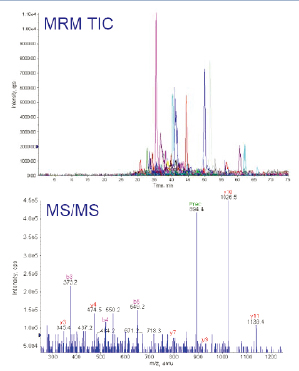
图6. MIDASTM工作流程确认实验,通过83个母/子离子的提取离子质量色谱图(XIC)确认4个蛋白质(上图),得到双电荷m/z894.4的MS/MS谱图的碎片离子确认RBM17的多肽序列为CVIFEIPGAPDDEAVR(下图)。
由于线性离子阱具有极高的灵敏度,即使在MRM扫描中非常低的离子信号,在线性离子阱MS/MS扫描中也可以获得高质量的MS/MS图谱来验证确认蛋白质。如图6下图所示,即使是丰度很低的肽段(CVIFEIPGAPDDEAVR),它的MS/MS图谱质量仍然很好,可以清晰地看到从脯氨酸氨基端碎裂而形成的y10离子。
数据库检索结果
通过MIDASTM方法,样本中被选择进行验证与确认工作的4个低丰度蛋白质都以高分值被验证,每个被确认的蛋白质MASCOT分值都高于100(图7上图所示)。蛋白质RBM17,被5个高分值的多肽所确认。其氨基酸覆盖率达到13.7%(图7)。
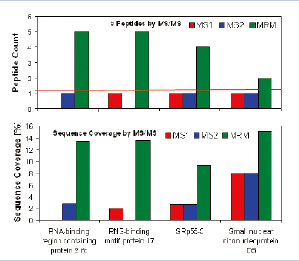
图7. 在MASCO检索结果中4个低丰度蛋白质都以高分值被验证(上图)。此外,蛋白质RBM17被5个分值都大于15的多肽序列所确认(下图)。
由于MIDASTM工作流程的高选择性与灵敏度,即便是在常规Nano-LC-MS/MS实验中模糊的鉴定结果,都可以准确地被验证其在样本中是否真实存在,避免了假阳性的结果,如图8所示。
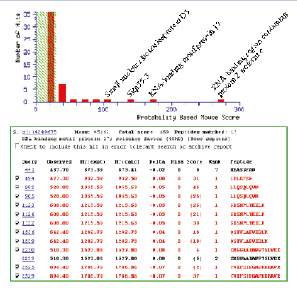
图8. 4种目标蛋白质确认结果总结,蓝色和红色柱状图为标准LC-MS/MS 实验,绿色为MIDASTM工作流程确认结果。
结论
由于MRM采集方式的高选择性与灵敏度,非常适合在动态变化且体系复杂的样本中验证低丰度蛋白质的存在。
在此项实验中,结合4000
QTRAP线性离子阱串联三级四极杆质谱系统,基于MRM的MIDASTM技术方案成功验证了低丰度的4个蛋白质确实存在于人体mRNA剪拼体复合物中。与常规Nano-LC-MS/MS质谱仪蛋白质鉴定实验相比,由MRM引导的线性离子阱MS/MS扫描显著提高了氨基酸覆盖率,增强了可信度与准确性(图8)。
MIDASTM技术方案充分利用了QTRAP这类(线性离子阱串联三级四极杆)质谱系统的功能特点,既通过其三级四极杆的MRM扫描模式验证存在性,又利用其线性离子阱MS/MS扫描灵敏度高的特点确认真实性。因此,MIDASTM技术方法将在生物标志物的验证与确认领域发挥越来越重要的作用。
【参考文献】
1. Baldwin MA, Mol. Cell. Proteomics 3, 1-9 (2005).
2. Panchaud A, Kussmann M and Affolter M, Proteomics 5, 3836-46 (2005).
3. Chamrad DC, koerting G, Stühler K, Meyer HE, Klose J and Blüggel M, Proteomics 4, 619-28 (2004).
4. Unwin RD, Griffiths JR, Leverentz MK, Grallert A, Hagan IM and Whetton AD, Mol. Cell. Proteomics 4, 1134-1144 (2005).
5. Cox DM, Zhong F, Du M, Duchoslav E, Sakuma T and McDermott JC, J. Biomol. Tech. 16,83-90 (2005).
6. Hartmuth K, Urlaub H, Vornlocher HP, Will CL, Gentzel M, Wilm M and Lührmann R, PNAS 99, 16719-24 (2000)
-
焦点事件
-
焦点事件

-
精英视角















