抗体纯化工艺开发平台策略-亲和层析篇
介绍
在抗体药物纯化工艺中,通常采用经典的三步或两步层析法,蛋白A(Protein A)亲和介质(填料)因其配基上有多个区域对抗体Fc片段具有特异性吸附能力,因此广泛用于抗体捕获步骤(第一步层析)。通过一步亲和工艺,可去除细胞培养澄清液中大部分的杂质,纯度可达95%以上。然而,蛋白A亲和层析填料较昂贵,可占抗体药物下游纯化工艺中层析填料成本的80%以上。因此,亲和层析工艺的选择不仅需要关注产品质量,还要从成本角度考虑到最终产品的市场竞争力。
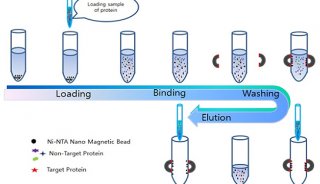
随着纯化技术的发展,Protein A层析填料在不断的改进,目前用于抗体捕获的重组Protein A可以与琼脂糖微球等填料基质进行多点偶联,进而减少了使用过程中配基脱落的现象,影响层析结果。此外,为满足生物制药工艺清洁及消毒的要求,Protein A层析填料一般可以耐受0.1-0.5M氢氧化钠的处理。需要注意的是,不同厂家的Protein A亲和层析填料在耐碱性、结构序列、填料基质偶联方式、结合载量以及配基脱落率等方面存在较大差异,因此在选择Protein A亲和层析填料时一定要系统考量,通过科学的实验对淋洗条件、洗脱方式和保留时间等步骤进行详细的工艺开发,在保证产品质量的同时,尽可能降低相关成本。亲和层析原理见图1。

图1. 亲和层析原理图
亲和层析
亲和层析工艺主要由5个部分组成:
1. 平衡:用平衡液对层析填料进行平衡,达到最佳结合状态;
2. 上样:让目的蛋白充分的与填料接触,达到良好的吸附效果;
3. 淋洗:用淋洗液冲洗掉非特异性结合的杂质;
4. 洗脱:将结合的目的蛋白从层析填料上洗脱,达到分离纯化的效果;
5. 清洗:对使用完的层析填料进行再生及消毒。
常规抗体亲和层析工艺流程见图2。

图2. 亲和层析工艺步骤
在亲和层析工艺开发阶段,平衡步骤已经趋于平台化,各公司均有平台缓冲液及相关的方法可以达到良好的平衡效果,在清洗步骤上,可以根据厂家推荐的清洗方式进行填料的再生及消毒,基本不需要进行相关的工艺开发工作。但是在上样、淋洗及洗脱阶段,由于不同蛋白在不同的填料上层析表现及产品质量会有较大的差异,因此需要进行详尽的载量测试实验、淋洗工艺的优化及洗脱工艺的优化实验,以获得最终的亲和层析工艺,开发策略见表1。
表1. 抗体类药物亲和层析工艺开发平台策略

动态结合载量(DBC)测试
Protein A亲和层析为结合-洗脱模式,蛋白分子在层析柱里的保留时间对结合载量具有显著的影响。推荐考察6 min保留时间条件下,填料对目的分子的结合能力。在上样过程中,取不同点的流穿液检测Titer,并绘制流穿曲线,以确定填料的动态结合载量,然后以动态结合载量的80%作为安全限度,确定最终的载量范围,推荐实验方案如表2:
表2. 亲和层析填料DBC测试实验方案



图3. 亲和层析DBC测试目的蛋白流穿图(举例)
亲和层析淋洗条件优化
亲和层析上样结束后,在洗脱之前一般会加入淋洗步骤,目的是去除非特异性结合的杂质如HCP和HCD等。经典的冲洗方式为高盐溶液淋洗(0.5-1.0M NaCl)及弱酸性溶液淋洗(pH5.0-6.0)。在工艺开发过程中,可以考虑组合不同的淋洗方式,考察其对杂质的去除效果,对冲洗条件进行筛选,推荐实验方案如表3。实验完成后,亲和层析收集样品检测SEC纯度、HCP及HCD残留,计算收率,选择最佳的淋洗工艺。特别提醒,淋洗工艺的选择可能会对整个亲和层析步骤在病毒去除的效果上产生较大影响,同时,也可能会对填料的使用寿命具有一定影响,因此淋洗工艺的开发不可忽视。
表3. 亲和层析淋洗条件优化实验方案

亲和层析洗脱条件优化
Protein A和抗体Fc段的结合主要以His残基之间的静电作用为主,因此,Protein A亲和层析通常采用降低缓冲液pH的方式进行洗脱,当洗脱pH降低至4.5以下时,His残基带正电荷,抗体上His残基与Protein A上的His残基产生静电排斥作用,抗体从Protein A上解离。有研究表明,洗脱阶段不同的缓冲液类型会对产品质量和层析收率有明显影响,因此亲和层析洗脱阶段的优化,通常需要先对缓冲体系进行筛选,推荐实验方案见表4。
表4. 亲和层析洗脱缓冲液筛选实验方案

除缓冲体系外,针对不同的亲和填料,不同的洗脱pH也会影响蛋白与Protein A的解离效果,对工艺的收率产生影响,并且对收集产品中的杂质(聚体、片段等)和残留(HCP、HCD和Protein A等)水平也有较大影响。因此,需要对洗脱pH进行研究,样品检测SEC纯度、 nrCE纯度及残留,并计算收率,筛选出符合预期的洗脱条件,推荐实验方案见表5。
表5. 亲和层析洗脱pH优化实验方案
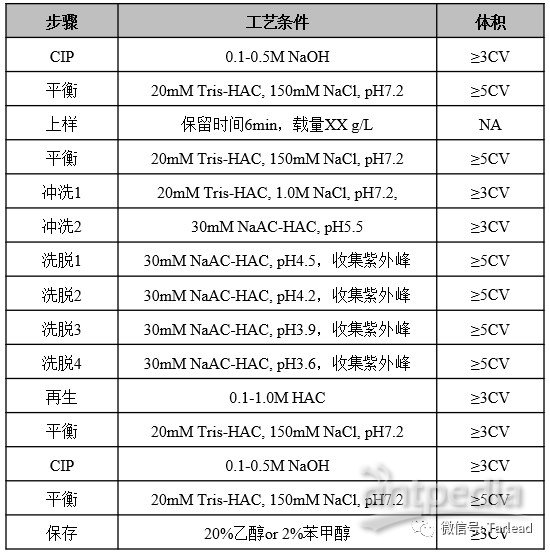
亲和填料清洗条件优化
Protein A层析填料通常可以使用高浓度的离液剂进行再生,比如6M尿素和6M盐酸胍等,但是由于这些试剂使用成本较高,一般不推荐使用。在早期的工艺开发阶段可以使用厂商推荐的方案进行填料的清洗和再生。目前比较常见的方法为弱酸/氢氧化钠的组合进行清洗,比如1M醋酸加0.1-0.5M氢氧化钠。针对不同的亲和填料,由于Protein A本身的耐碱性能差异较大,因此氢氧化钠的浓度需要谨慎选择。如果项目进行至晚期研究阶段,在进行填料寿命研究之前,建议对填料的清洗方法进行详细的开发,以便最大限度的延长使用寿命。
病毒去除
Protein A亲和层析除了对HCP和HCD等杂质具有良好的去除效果,同时对一些病毒的去除也有不错的效果,如对异嗜鼠白血病病毒(X-MuLV)的去除率(LRV)通常在1.0-3.5范围内,对鼠细小病毒(MVM)的去除率(LRV)在0.0–3.0范围内。具体的LRV值与亲和层析本身的工艺条件息息相关,这可能是由于病毒与填料的非特异性结合或病毒与被捕获的蛋白分子之间的非特异性结合所导致。因此,Protein A亲和层析工艺在开发过程中需要适当考虑对病毒的去除效果并进行优化,比如可以在淋洗缓冲液中加入去污剂,高盐溶液等。
表6. ProteinA亲和层析病毒去除研究结果(举例)

总结
本文着重介绍了亲和层析工艺开发过程中需要重点关注的部分工艺参数,除此之外,在实际执行亲和层析工艺开发时,如柱高、紫外峰收集范围等工艺参数也需要综合考虑,只是此类参数在开发过程中可依据公司平台制定,通常无需专门设计实验进行研究。另外需要注意的是,在亲和层析的淋洗及洗脱开发阶段,如果按照上述常规方法开发时出现淋洗效果不佳、洗脱过程中出现拖尾现象或洗脱收集样品聚体含量较高等情况,则可以考虑在相应的缓冲液中加入一些金属盐、氨基酸或去污剂等添加剂进行实验,常用的添加剂包括氯化钙、氯化镁、精氨酸和吐温20等。
参考文献
1. Process Scale purification of antibodies. UWE GOTTSCHALK. Lonza AG. Basel Switzerland.
2. Biopharmaceutical Processing Development, Design, and Implementation of Manufacturing Processes. Günter Jagschies. Eva Lindskog. Karol Łącki. Parrish Galliher
3. Li, Y. A brief introduction of IgG-like bispecific antibody purification: methods for removing product-related impurities. Protein Expression and Purification, 2019,155, 112-119
4. Timothy M. Pabst∗, Johnny Thai, Alan K. Hunter. Evaluation of recent Protein A stationary phase innovations forcapture of biotherapeutics. Journal of Chromatography A, 1554 (2018) 45–60
5. Development of purification processes for fully human bispecific antibodies based upon modification of protein A binding avidity. mAbs, DOI:10.1080/19420862.2016.1160192