抗体的亲和层析法纯化技术
实验概要
本实验介绍了抗体亲和层析法纯化的操作流程。
实验原理
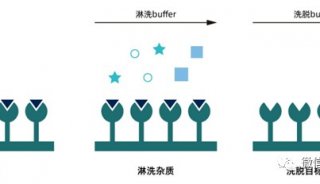
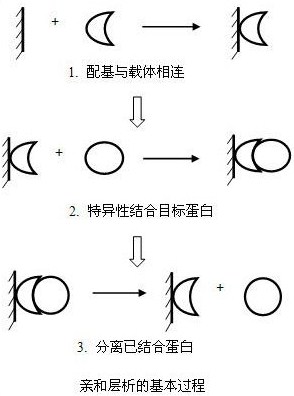
亲和层析的高度选择性使得从某一初始材料中纯化,富集某一含量较低的目的蛋白成为可能,因此亲和层析是蛋白质分离纯化过程中最有效的方法之一。另外,如果配基与蛋白质的亲和能力很强,也可同时进行样品的浓缩。
虽然多数情况下不需要将抗体与其他血清蛋白分开,但如果一旦需要,蛋白A亲和层析是一种非常有效的分离方法。蛋白A是从Staphylococcus
aureus中获得,可与抗体重链的Fc片段相结合。现在已知蛋白A可与多种哺乳动物的IgG相结合也可与某些IgM和IgA相结合。如果将蛋白A与固相载体相连,例如sepharose
CL-4B,这种填料可以成为分离和纯化不同类型,不同亚类抗体或抗体片断的重要工具。
主要试剂
1. TBS缓冲溶液:6.06g Tris (50 mM),8.78g NaCl (150 mM)以及0.5g叠氮化钠(0.05%)溶于1L蒸馏水中,并用HCl调节pH7.4。
2. 中和缓冲溶液:121.2g Tris (1 M),87.8g NaCl (1.5 M),0.37g EDTA (1mM)及5g叠氮化钠(0.5%)溶于1L蒸馏水中,并用HCl调节pH8.0。
3. 洗脱缓冲溶液(pH2.7):将3.75g甘氨酸(50 mM)溶解于1L蒸馏水中,用HCl调节pH 2.7。
4. 洗脱缓冲溶液(pH1.9):将3.75g甘氨酸(50 mM)溶解于1L蒸馏水中,用HCl调节pH 1.9。
主要设备
蛋白A柱(含10ml或5ml填料);泵;离心管;离心机;pH试纸;过滤器;玻璃柱。
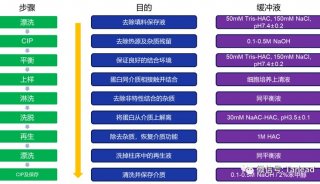
实验步骤
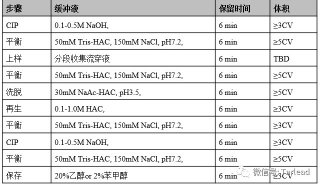
1. 准备蛋白A sepharose CL-4B亲和柱
通常准备5ml或10 ml蛋白A sepharose CL-4B填料,在真空瓶中将等体积的填料和TBS缓冲溶液混合,搅拌。抽真空约15分钟以除去填料中的气泡,否则在柱中形成的气泡影响柱子的容量和分离效果。将蛋白A sepharose CL-4B填料缓慢加入玻璃柱中,利用泵控制填充速度为1 ml/分-2 ml/分,避免柱干,利用10倍于床体积并经过预冷的TBS缓冲溶液平衡柱子。
2. 制备抗血清
将抗血清放入冰水或4oC冰箱中缓慢解冻以避免蛋白质的聚集。在蛋白质解冻过程中出现的聚集可通过37oC预热而溶解。加入固体叠氮化钠至浓度为0.05%,4oC,15000xg离心5分钟,移出澄清的抗血清再经过滤器过滤除去多余的脂。
3. 亲和层析
将抗体用TBS缓冲溶液以1:5的比例进行稀释,再用过滤器进行过滤。以每分钟0.5 ml的速度将抗血清上到柱上,为保证抗血清与填料的结合,需连续上柱2次并保留上样流出液。用TBS缓冲溶液清洗柱子至Aλ280nm<0.008后加pH2.7洗脱缓冲溶液,以0.5ml/min的速度洗脱至所有蛋白均流下来。用已经加入100ul中和缓冲溶液的1.5 ml EP管分管收集洗脱液,混匀后用pH试纸检查洗脱液的pH,如果pH低于7可利用中和缓冲液调至约pH7.4以防止抗体的变性。
在柱中加入10ml,pH1.9洗脱缓冲溶液,按上述方法收集洗脱液至Aλ280nm<0.008。
利用分光光度计测定各管中蛋白质的含量。若蛋白浓度低于0.5mg/ml可加入10%的甘油以便保存,将纯化的抗体分装后在2oC~8oC保存。
用含0.05%叠氮化钠的TBS缓冲溶液清洗柱子后将柱子储存在2oC~8oC环境。
4. 实验结果
利用SDS/PAGE检查洗脱获得的蛋白纯度并利用免疫电泳技术检查纯化后抗体的滴度。