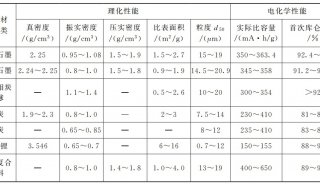
中大吴耀文eLife:肺炎细菌抵御人体细胞自噬的清除作用
一项新的研究成果揭示了细菌毒性效应子抑制细胞自噬的分子机制,该研究详细地阐释了嗜肺军团菌(Legionellapneumophila)利用其分泌的毒性效应子RavZ切除细胞自噬的关键蛋白质LC3-PE(磷脂酰乙醇胺修饰的LC3蛋白)的分子机制,嗜肺军团菌利用该机制导致宿主细胞自噬体无法形成,从而有效地规避了宿主细胞的抵御功能。
这一研究由吴耀文博士领衔的中山大学医学院和德国马普化学基因组学中心(ChemicalGenomics Centre of the Max Planck Society)的联合团队完成,相关研究结果发表在eLife杂志上。
嗜肺军团菌是一类革兰氏阴性菌,一种原发的人类病原体,是造成肺炎的常见病菌,死亡率可以达到约30%。该细菌在自然界十分普遍,尤其在25-45℃的温暖环境,比如流动性较差的热自来水储存箱和水冷式空调机的冷却水中。细胞自噬(autophagy)是依赖溶酶体途径对胞质蛋白和细胞器进行降解的一种过程,在维持细胞动态平衡中发挥了重要作用。细胞自噬也能清除入侵胞内的细菌,是一种宿主细胞抵御细菌感染的重要机制。某些细菌已经进化出一些机制来规避宿主细胞自噬,以达到在宿主细胞内生长和增殖的目的。
“我们希望通过研究嗜肺军团菌规避宿主细胞自噬的机制,为开发有效的抗菌药物提供途径。”吴耀文博士说。
研究表明,嗜肺军团菌通过IV型分泌系统可将毒性效应蛋白RavZ注入宿主细胞,抑制宿主细胞自噬活性,从而使细菌在细菌-宿主竞争中获得优势。由于缺乏合适的研究工具,RavZ如何识别和切除 LC3-PE从而实现对细胞自噬的抑制一直困扰着科学家们。
吴耀文团队巧妙地利用化学方法合成制备了一系列末端修饰的LC3蛋白质复合物,利用这些化学修饰的蛋白质工具,他们研究了RavZ作用于LC3-PE的结构-效能关系,再结合结构生物学、生物物理和细胞生物学方法,首次揭示了RavZ识别和切除 LC3-PE的分子机制。
研究显示,嗜肺军团菌感染宿主细胞后,将毒性效应子RavZ注入宿主细胞,RavZ首先通过自身包含的LC3 作用域(LC3-interacting region,LIR)与膜上的LC3结合,同时通过碳端结构域特异地与自噬体的膜上的磷脂酰肌醇3-磷酸(Phosphatidylinositol 3-phosphate,PI3P)结合。RavZ还通过一个疏水性的α-螺旋(α3)插入到膜中,得以把LC3-PE的磷脂酰乙醇胺脂链从膜中“拔出”,从而形成RavZ与LC3-PE的复合物,RavZ再利用其蛋白酶活性切除LC3-PE的脂链,使得LC3蛋白质无法再重新脂基化,最终导致细胞自噬体无法形成,从而抑制了宿主细胞的自噬活性,嗜肺军团菌得以在宿主细胞内存活。
“嗜肺军团菌的毒性效应子RavZ演化出‘镊子’和‘剪子’双功能,前者把LC-PE从膜中拔出,后者特异地把LC3-PE的脂链切除,就像做外科手术一样,是一个非常精巧的分子机器。这可能是细菌在进化过程中,为了抵御宿主细胞自噬的清除,演化出来的一种非常聪明的抵抗机制。”吴耀文博士解释说。
这项研究不仅揭示了一种全新的细菌与宿主的作用机制,而且通过对这一机制的研究,该团队还找到了抑制RavZ活性的有效途径,他们发现一个多肽化合物可以很好的抑制RavZ对LC-PE的剪切,这为进一步开发特异的抗菌药物提供了广阔的前景。