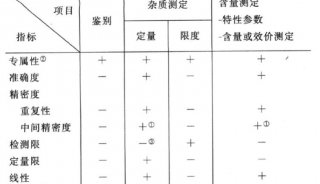
中国药典(GMP)制药用水要求详解
制药企业的生产工艺用水,涉及到的是1)制剂生产过程当中容器清洗、配液及原料药精制纯化等所需要使用的水,此类用水一般分成纯化水和注射用水两大类。中国药典对此两类制药用水的制备工艺有具体的一个要求。对于注射用水,中国药典要求使用蒸馏的方法制备,通常是使用多效蒸馏器。此要求与FDA、UP和JP的要求差别较大,本文在此就不详谈制备方面的差别,下文主要谈一谈中国药典(GMP)对制药用水的各方面要求,尤其对纯化水和注射用水的TOC检测要求。
一、同制药用水的用途差别
纯化水的用途:
1、制备注射用水(纯蒸汽)的水源
2、非无菌药品直接接触药品的设备、器具和包装材料最后一次洗涤用水
3、注射剂、无菌药品瓶子的初洗
4、非无菌药品的配料
5、非无菌药品原料精制
注射用水的的用途
1、无菌产品直接接触药品的包装材料最后一次精洗用水
2、注射剂、无菌冲洗剂配料
3、无菌原料药精制
4、无菌原料药直接接触无菌原料的包装材料的最后洗涤用水
纯蒸汽的用途
1、无菌药品物料、容器、设备、无菌衣或其他物品需进入无菌作业区的湿热无菌处理
2、培养基的湿热灭菌
二、2010年版中国药典(GMP)对注射用水中总有机碳(TOC)的新要求
为什么需要检测总有机碳(TOC)
微生物超标纠正标准是指微生物污染达到某一数值,表明注射用水系统已经偏离了正常运行的条件,应采取纠偏措施,使系统回到正常的运行状态。“热原”通常是由细菌产生的,是那些能致热的微生物的代谢产物,以“细菌内霉素”指标来表示。大多数细菌和许多霉菌都能产生热,致热能力最强的是革兰阴性杆菌的产物。微生物代谢产物中的内毒素是造成热原反应的最主要因素。细菌内毒素耐热性强,其尺寸大小约在1-50μm之间,故可通过一般滤器进入滤液中,但能被活性炭、硅藻土滤器等吸附。热原本身不挥发,但能在蒸馏时被汽化的水滴带入蒸馏水中。总有机碳TOC=TC(总碳)-IC(无机碳)。
总有机碳的指标在一定意义上说明的是对水污染的监控。各种有机污染物,微生物及细菌内毒素经过催化氧化后变成二氧化碳,进而改变水的电导,电导的数据又转换成总有机碳的量。如果总有机碳控制在一个较低的水平上,意味着水中有机物、微生物及细菌内毒素的污染处于较好的受控状态。这也是一些验证资料中将总有机碳作为验证项目的重要原因。
没有检测TOC会有什么后果?
1、不知道药品已受污染,以及不知道什么原因和什么时候受到污染
2、纯水系统的过滤装置需要更换而不知道
3、管路设计上存在死角兹长微生物而不知道
4、引入新杂质不能通过验证
药典要求
美国USP委员会建立要求制药(其他相关)公司遵守的质量标准和准则
美国FDA通过检查强制执行这些标准
USP<645>要求制药用水检测电导率
USP<643>要求制药用水检测TOC
中国2010年药典将会遵循美国FDA的要求,要求对制药用水检测TOC
根据目前掌握的信息,中国药典2010版将会对注射用水(WFI)强制要求测量TOC,纯化水建议测量TOC。
中国药典对PAT(过程分析技术)要求
PAT全称为过程分析技术
美国FDA正在进行PAT倡仪,即建议所有指标检测均需进行在线检测,以确定最终产品的质量。