钠原子光谱
钠原子由一个完整而稳固的原子实和它外面的一个价电子组成。原子的化学性质以及光谱规律主要决定于价电子。与氢原子光谱规律相仿,钠原子光谱线的波数可以表示为两项差:
其中n* 为有效量子数,当 n* 无限大时,![]() ,
, ![]() 为线系限的波数。钠原子光谱项为:
为线系限的波数。钠原子光谱项为:
![]()
它与氢原子光谱项的差别在于有效量子数不是整数,而是主量子数n减去一个数值Δ,即量子修正Δ,称为量子缺。量子缺是由原子实的极化和价电子在原子实中的贯穿引起的。
碱金属原子的各个内壳层均被子电子占满,剩下的一个电子在最外层轨道上,此电子称为价电子,价电子与原子的结合较为松散,与原子核的距离比其他内壳层电子远得多,因此可以把除价电子之外的所有电子和原子核看作一个核心,称为原子实。由于价电子电场的作用,原子实中带正电的原子核和带负电的电子的中心会发生微小的相对位移,于是负电荷的中心不再在原子核上,形成一个电偶极子。极化产生的电偶极子的电场作用于价电子,使它受到吸引力而引起能量降低。同时当价电子的部分轨道穿入原子实内部时,电子也将受到原子产的附加引力,降低了势能,此即轨道贯穿现象。原子能量的这两项修正都与价电子的角动量有关,角量子数越小,椭圆轨道的偏心率就越大,轨道贯穿和原子实极化越显著,原子能量也越低。因此,价电子越靠近原子实,即n越小、越小时,量子缺Δ越大(当n较小时,量子缺主要决定于l,实验中近似认为Δ与n 无关)。电子由上能级(量子数为n,l,)跃迁到下能级(n′,l′), 发射的光谱线的波数由上式决定:
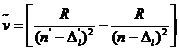
如果令n′,l′固定,而n依次改变(l的选择定则为![]() ),则得到一系列的
),则得到一系列的![]() 它们构成一个光谱线系。光谱中常用n′,l′,-nl,这种符号表示线系。分别用S,P,D,F表示。钠原子光谱有四个线系:
它们构成一个光谱线系。光谱中常用n′,l′,-nl,这种符号表示线系。分别用S,P,D,F表示。钠原子光谱有四个线系:
主线系(P线系):3S-nP, n=3,4,5,…;
漫线系(D线系):3P-nD, n=3,4,5,…;
锐线系(S线系):3P-nS, n=4,5,6,…;
基线系(F线系):3P-nF, n=4,5,6,…;
在钠原子光谱的四个线系中,只有主线系的下级是基态(3S1/2能级),在光谱学中,称主线系的第一组线(双线)为共振线,钠原子的共振线就是有名的黄双线(589.0nm和589.6nm)。钠原子的其他三个线系,基线系在红外区域,漫线系和锐线系除第一组谱线在红外区域,其余都在可见区域。
主线系光谱是![]() (n=3,4,…….)之间跃迁产生的,其中上能级是双重的,下能级是单重的,因此,根据选择定则,主线系是双重结构。其短波成分和长波成分的强度比是2:1。跃迁的能级图如下:
(n=3,4,…….)之间跃迁产生的,其中上能级是双重的,下能级是单重的,因此,根据选择定则,主线系是双重结构。其短波成分和长波成分的强度比是2:1。跃迁的能级图如下:

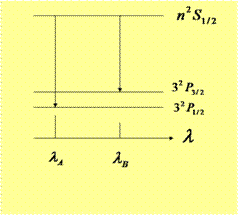
锐线系光谱是![]() 之间跃迁产生的,上能级是单重的,下能级是双重的。根据选择定则,锐线系是双重结构,且其短波成分和长波成分的强度比是1:2。上能级是单重的,下能级是双重的。根据选择定则,锐线系是双重结构,且其短波成分和长波成分的强度比是1:2。跃迁的能级图如下:
之间跃迁产生的,上能级是单重的,下能级是双重的。根据选择定则,锐线系是双重结构,且其短波成分和长波成分的强度比是1:2。上能级是单重的,下能级是双重的。根据选择定则,锐线系是双重结构,且其短波成分和长波成分的强度比是1:2。跃迁的能级图如下:
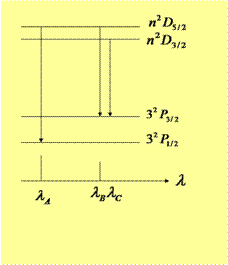
漫线系光谱是![]() (n=3,4,…….)之间跃迁产生的,这时上、下能级都是双重的。根据选择定则,漫线系应该有三条谱线,分别记为
(n=3,4,…….)之间跃迁产生的,这时上、下能级都是双重的。根据选择定则,漫线系应该有三条谱线,分别记为![]() ,但由于
,但由于![]() 相距很近,通常无法分开,两个成分合二为一,其波长用
相距很近,通常无法分开,两个成分合二为一,其波长用![]() 表示,称为复双线结构。其短波成分和长波成分的强度比为1:2. 能级图如下:
表示,称为复双线结构。其短波成分和长波成分的强度比为1:2. 能级图如下: