分子伴侣调控无膜细胞器动态组装研究中的进展
蛋白质的相分离在多种执行重要生物学功能的无膜细胞器动态组装中发挥关键作用。在疾病条件下,蛋白质相分离调控的紊乱会直接导致蛋白的液-固相转化和不可逆的蛋白致病聚集。该过程与一些神经退行性疾病,如肌萎缩侧索硬化症(ALS)密切相关。然而目前,学界缺乏关于蛋白相分离稳态在不同无膜细胞器中如何被精密调控的研究。近日,中国科学院上海有机化学研究所生物与化学交叉中心刘聪课题组、方燕姗课题组与上海交通大学的研究人员合作,发现了一类维持无膜细胞器中蛋白稳态的关键分子伴侣Hsp40。其自身具有较强的相分离能力,并能够与无膜细胞器中的蛋白发生协同相分离,在维持蛋白质高度动态的相分离中起到关键作用。相关研究成果发表在Proc. Natl. Acad. Sci. USA上。
分子伴侣(热休克蛋白)广泛参与细胞内蛋白质内稳态的维持。研究表明,不同的热休克家族蛋白存在于多种无膜细胞器中,如应激颗粒(SGs)中鉴定出Hsp40、Hsp70、Hsp90等。然而,学界对分子伴侣在无膜细胞器动态组装中的作用仍缺乏研究。该研究中,研究人员发现了调控蛋白相分离的一类重要分子伴侣Hsp40。该研究首次发现分子伴侣自身具有相分离能力,并能够通过自身相分离参与到不同无膜细胞器的组装及稳态维持中。该研究对分子伴侣在无膜细胞器稳态的维持,以及蛋白分相调控紊乱与疾病关系的研究均具有重要意义。
Hsp40家族蛋白种类繁多,可分为三类亚型:I型、II型、Ⅲ型,这三类亚型均包含参与Hsp70 ATP水解的J domain。除了J domain,I型与II型蛋白的氨基端(NTD)还具有甘氨酸/苯丙氨酸富集的柔性区域——G/F区域,在羧基端(CTD)具有底物结合结构域。研究发现,Hsp40的I型与II型蛋白成员——Hdj2与Hdj1在体外均具备较强的相分离能力,并且在细胞内存在于不同的无膜细胞器中。其中,Hdj2定位于细胞核内的核仁中,Hdj1定位于泛素化富集的核小体中;在压力刺激下,两者均会参与到细胞质SGs的形成中。进一步机理研究发现,柔性G/F区域中的多个苯丙氨酸和精氨酸残基对Hsp40的分相及其参与SGs的组装具有重要意义。G/F区域在不同亚型及不同种属的Hsp40蛋白中广泛存在,进一步实验验证了含有G/F区域的酵母Hsp40蛋白Sis1与Ydj1均具有较强的相分离能力。因此,相分离可能是Hsp40家族不同成员共有的属性。
Hsp40家族蛋白在调控细胞蛋白质稳态中发挥重要作用,其功能缺失与一些疾病发病密切相关,Hsp40基因突变在ALS、帕金森症(PD)等神经退行性疾病中被发现。该研究发现,Hdj1能够与ALS重要致病蛋白FUS发生协同相分离,稳定FUS在高度动态的液-液相分离状态,并抑制FUS的致病性液-固相转化,从而维持细胞内的蛋白内稳态。进一步机理研究发现,Hdj1通过其NTD中的精氨酸及苯丙氨酸残基,分别介导与FUS-LC(1-163aa)和FUS-RGG(371-526aa)的相互作用及协同共分相。进一步,通过其CTD的底物结合结构域抑制液-液相分离状态中的FUS进一步进行液-固相转变。不同的分子伴侣在无膜细胞器动态组装和解离的多个不同阶段中可能存在不同作用。对多个不同分子伴侣协同或分段调控无膜细胞器的机制研究,将是该领域的重点研究方向。
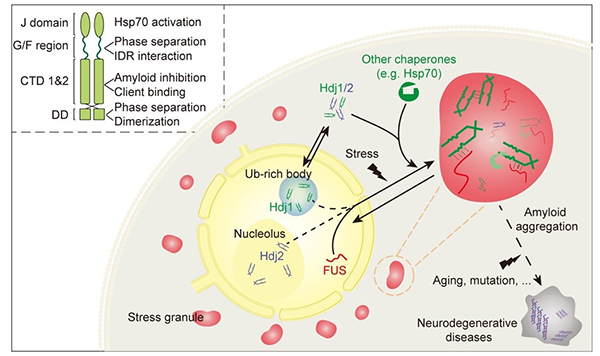
Hsp40参与无膜细胞器形成及其稳态维持示意图
-
综述
-
焦点事件

-
焦点事件