节食减肥为啥容易体重反弹?Cell Metab 研究揭示:大脑!
节食是减肥减重的重要方法,但往往很多人节食结束后体重又反弹。下丘脑的弓状核(ARC)被认为是体重增加的重要核团[1],体重变化如何引起ARC神经环路的变化从而调控体重呢?已有大量研究表明,ARC所接受的突触输入在应对热量不足时发挥作用,具体机制包括突触前末端[2]、突触形成以及突出修剪[3],以及突触后膜离子通道的表达。ARC核团能接收来自下丘脑室旁核(paraventricular hypothalamus,PVH)和背内侧下丘脑(dorsal medial hypothalamus,DMH),终床纹状核等核团的突触前输入,因此,探究ARC与体重调节的相互关系时特异性的环路调控尤为重要[4]。AgRP是ARC中与饥饿最相关的神经元,饥饿能激活AgRP神经元引起进食和体重增加;相反的,抑制AgRP神经元活性则减少进食并伴随体重减轻。食物剥夺、胃肠饥饿素升高或瘦素减低可增加AgRP的兴奋性突触输入、树突棘和自发性兴奋性突触后电流的频率。然而,这些兴奋性突触来自哪些神经元的投射、这些改变是否是机体应对能量状态改变的一种适应性机制未知。
2023年3月24日,来自德国普朗克代谢研究所的Henning Fenselau 团队在《Cell Metabolism》上发表了题为“A synaptic amplifier of hunger for regaining body weight in the hypothalamus”的论文,利用转基因小鼠,通过病毒特异性标记神经元、离体电生理记录和免疫荧光染色的方法,发现饥饿信号和体重减轻能增加PVHRH神经元投射至AgRP的兴奋性突触增加,引起PVHTRH神经元向AgRP神经元的兴奋性增强,并促进进食和体重增加。该研究从突触可塑性角度阐释了维持长期体重稳定的环路机制。

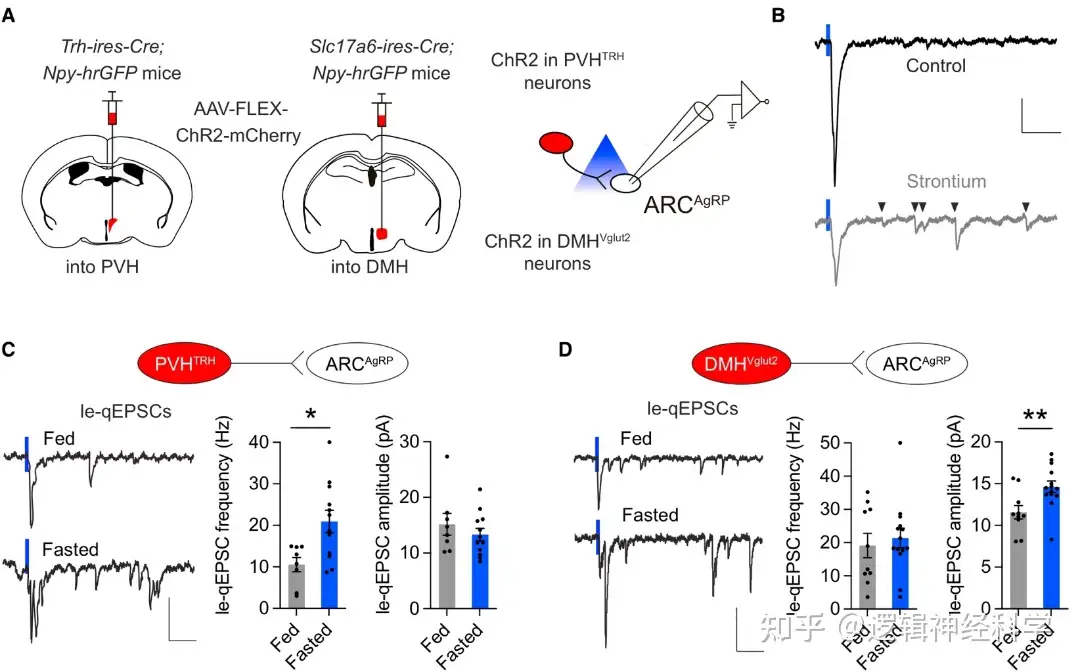
首先,通过在Trh-ires-Cre; Npy-hrGFP小鼠的PVH和DMH分别注射Cre依赖的ChR2病毒,在光刺激下同步记录AgRP的光刺激引起的突触后电流(light-evoked quantal EPSCs, le-qEPSCs),发现光刺激可以同步引起突触后电流,若用Sr2+离子代替Ca2+,则该突触后电流被扰乱,说明PVHTRH-AgRP以及DMHVglut2-AgRP有兴奋性突触连接(图1A-B)。通过比较正常和饥饿情况下,PVHTRH-AgRP和DMHVglut2-AgRP的le-qEPSCs,发现饥饿使PVHTRH-AgRP的le-qEPSCs频率增加而幅度不变(图1C),对DMHVglut2-AgRP的le-qEPSCs的则是提高了幅度而频率不变(图1D)。通过进一步分析le-qEPSCs的双脉冲比PPR,变异系数CV,以及AMPAR/NMDAR比例,发现PPR和离子通道特性都没有明显变化,提示PVHTRH-AgRP的le-qEPSCs频率增加是由于兴奋性树突棘的增加。
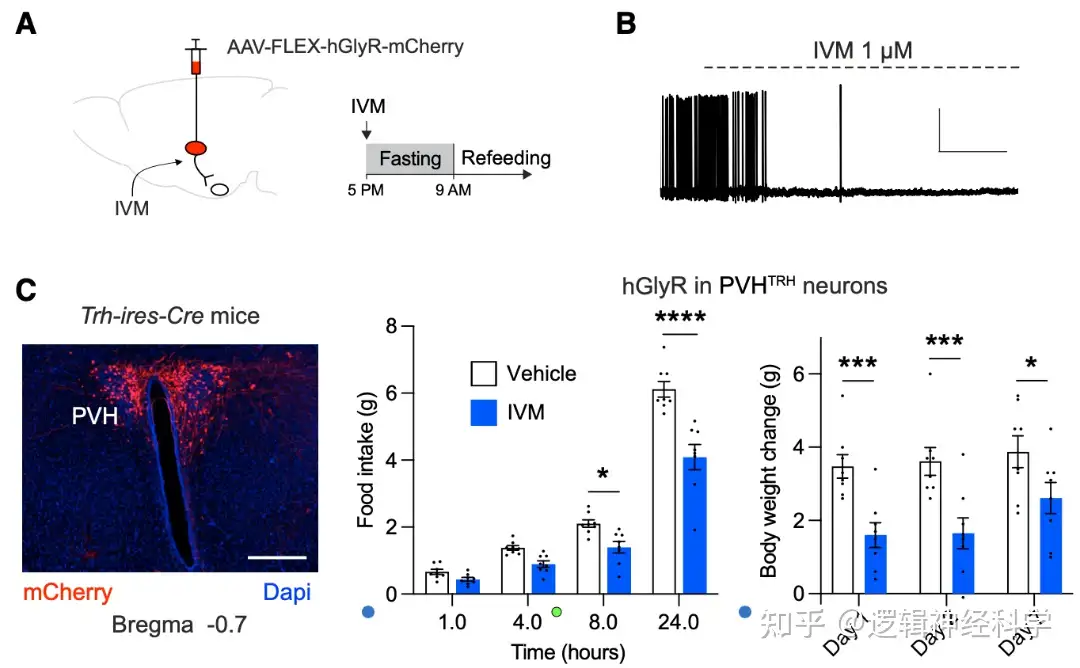
PVHTRH-AgRP和DMHVglut2-AgRP兴奋性突触的增强是否能在体重减轻后驱动进食行为?研究人员利用药理遗传学的方法,在Trh-ires-Cre小鼠的PVH和Slc17a6-ires-Cre小鼠的DMH注射Cre依赖的AAV-FLEX-hGlyR-mCherry病毒,并通过注射ivermectin(IVM)进行抑制(图2A-B),并记录饥饿后1-24小时的进食量以及1天、2天和7天后的体重变化。发现抑制PVHTRH活动后,小鼠的进食量和体重恢复相较于正常小鼠有所下降(图2C-D),而抑制DMHVglut2则对进食量和体重恢复没有明显影响,提示PVHTRH的激活是饥饿后进食和体重增加的必要条件。
PVHTRH神经活动的增加后,投射至AgRP的兴奋性输入是否也增加?通过在PVH表达hGlyR,并用IVM抑制PVH活性,在饥饿状态下记录AgRP sEPSC,发现沉默 PVHTRH 神经元消除了禁食诱导的 sEPSC 频率增加(图3C);另外,通过在PVH表达hM3Dq,并用CNO激活PVH活性,在饱食状态下AgRP记录sEPSC,发现激活PVHTRH 可诱发sEPSC 频率增加(图3D);表明,上游PVHTRH神经元的活动增加对于放大 AgRP 神经元的谷氨酸能突触输入是必要的。

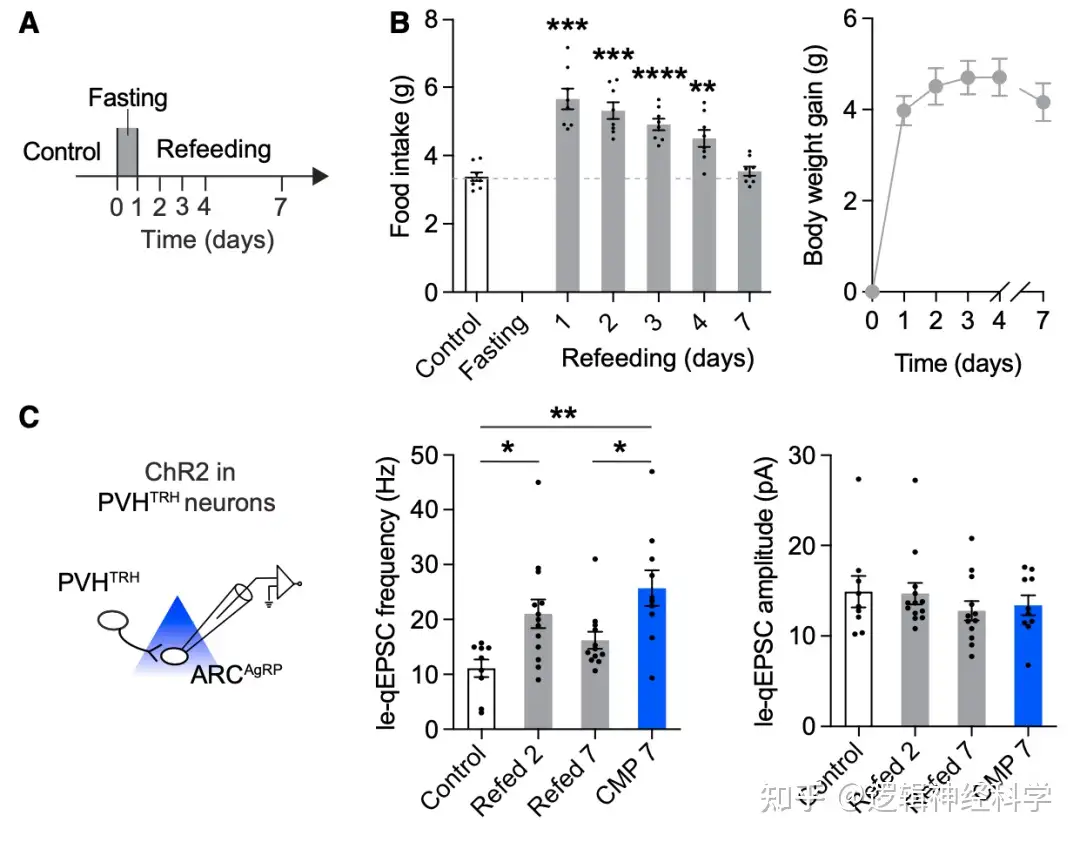
那么饥饿后PVHTRH-AgRP的兴奋性突触增加能维持多久?研究人员首先观察了饥饿24小时后恢复正常饮食,小鼠在此后7天的进食量和体重,发现进食量在恢复正常饮食的第7天恢复到饥饿前水平,相应的体重持续增加到第7天保持稳定(图4 A-B),与此同时,PVHTRH-AgRP的le-qEPSC的频率在限食期间持续增加,恢复喂养的第7天恢复到正常水平,因此,以上证据表明,饥饿后PVHTRH-AgRP的兴奋性突触增加是持续性的,这或许是是节食后进食增加和体重反弹的重要原因。
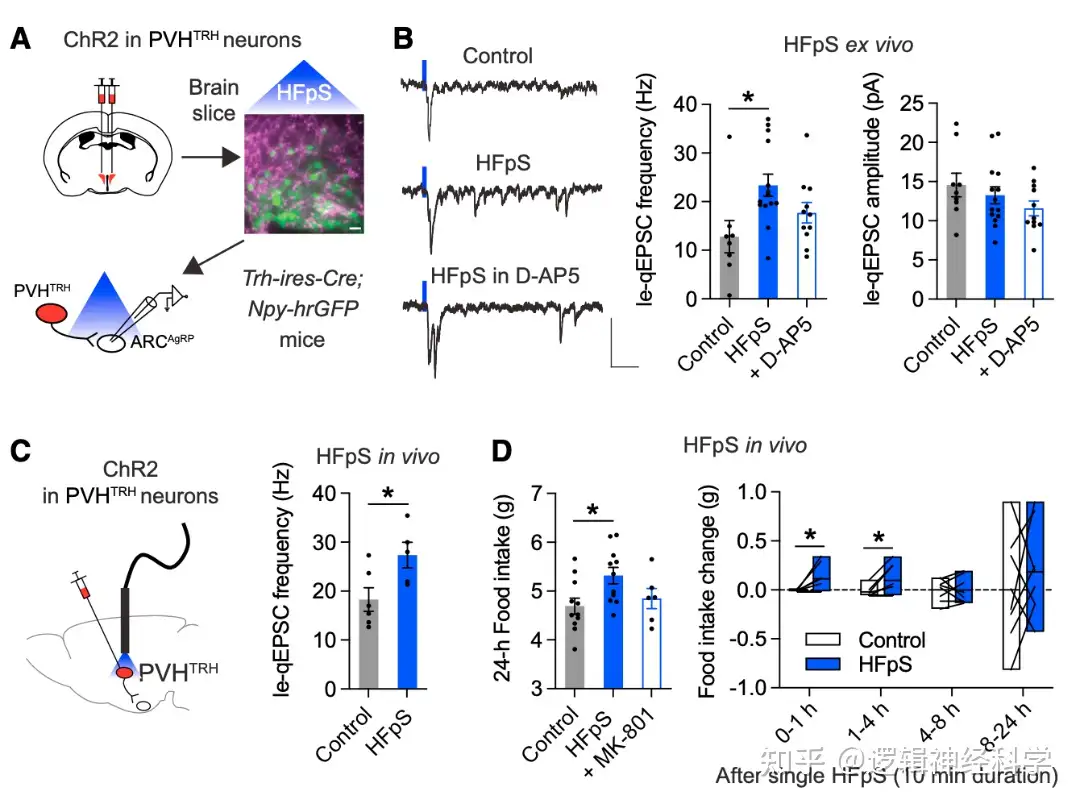
NMDAR在介导谷氨酸能突触中有重要作用。为了进一步验证NMDAR是否参与PVHTRH-AgRP的le-qEPSC,研究人员在双侧PVHTRH表达ChR2,以50Hz高频光刺激ARC并记录AgRP神经元的le-qEPSCs(图5A),发现10分钟的光刺激可引起PVHTRH-AgRP的le-qEPSC,加入NMDAR拮抗剂D-AP5后,le-qEPSC被抑制,说明NMDAR介导了PVHTRH-AgRP的兴奋性突触传递。进一步的行为学实验证明,50Hz的高频光刺激可引起光刺激后1-4小时内的进食量增加,而加入NMDAR拮抗剂MK-801则会抑制这一增加(图5C-D)。由此,50Hz高频光刺激可通过增加NMDAR介导的兴奋性突触传递以促进进食。
为了进一步验证PVHTRH-AgRP兴奋性突触介导了长期的促进进食,研究人员利用药理学手段在激活PVHTRH神经元的同时抑制AgRP神经元(图6D),结果发现若仅激活PVHTRH神经元可促进进食,但同时激活PVHTRH神经元和抑制AgRP神经元,则促进进食的作用被阻断(图6E),由此说明,AgRP神经元的激活是促进进食的必要条件。
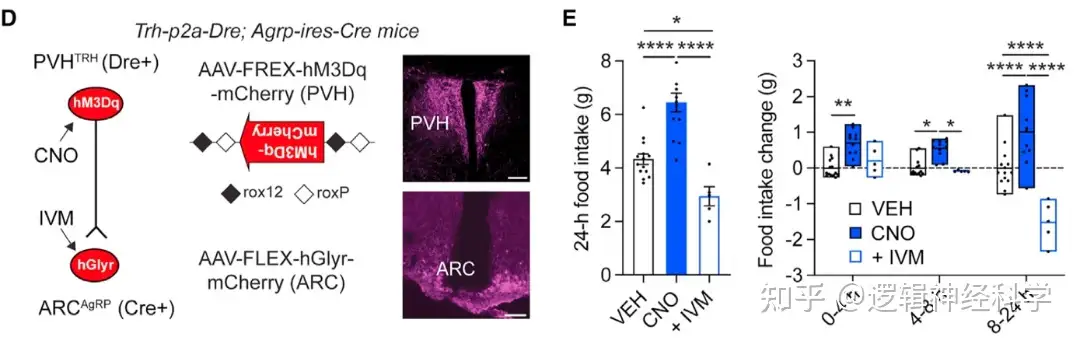
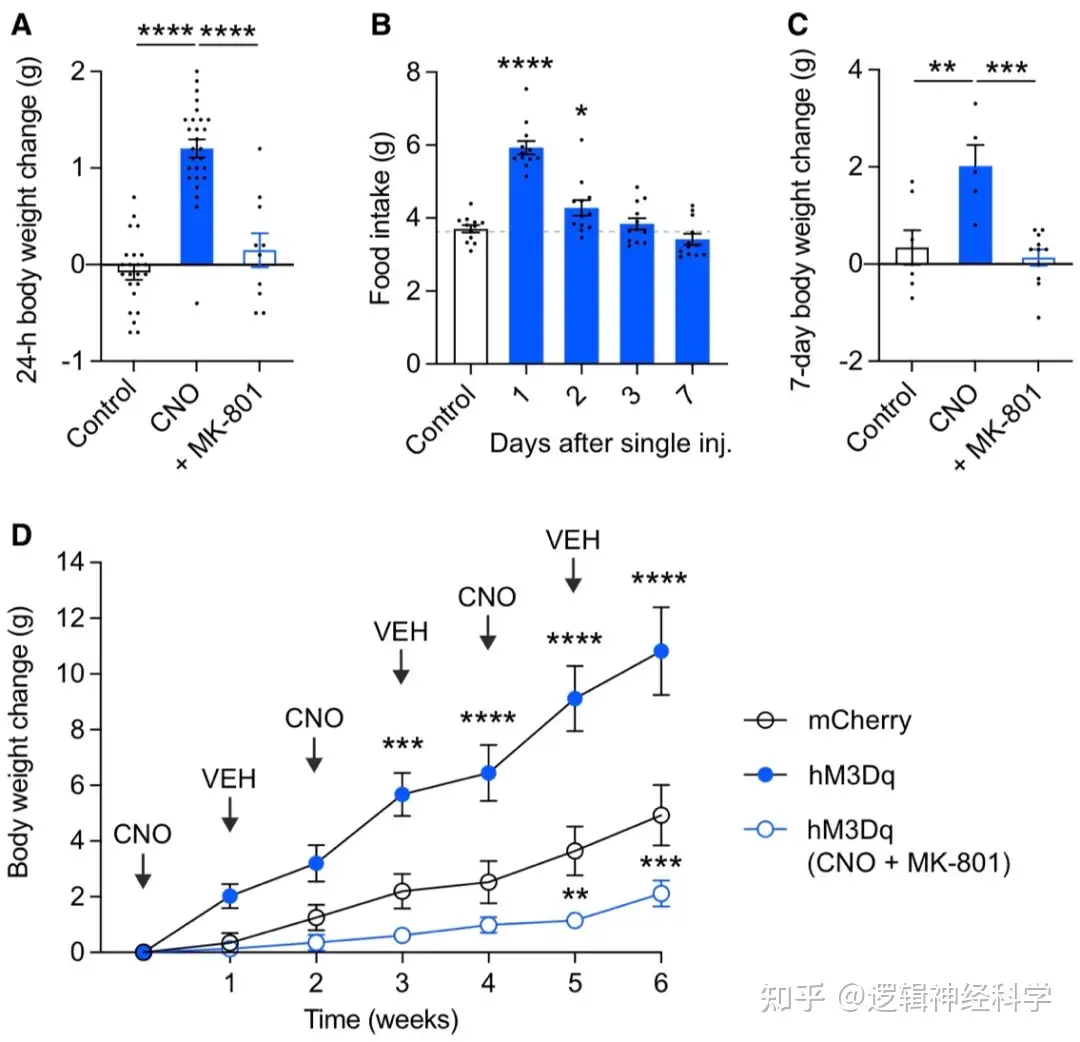
以上结果表明,体重减轻会激活PVHTRH神经元,从而增强PVHTRH-AgRP的兴奋性突触传递,并促进进食同时增加体重。为了直接证明这一点,研究人员检测了激活PVHTRH一周时间内,小鼠进食量和体重的变化。结果发现单次激活后24小时内,体重增加明显,进食量在给药后2天明显增加,若同时以NMDAR阻断剂,MK801来抑制兴奋性突触传递则体重无明显变化(图7A-B),单次激活组的小鼠7天后的体重也高于对照组和NMDAR抑制组(图7C)。与此一致的是,2 周和4周后单次CNO注射导致体重进一步增加(图7D)。
文章结论与讨论,启发与展望
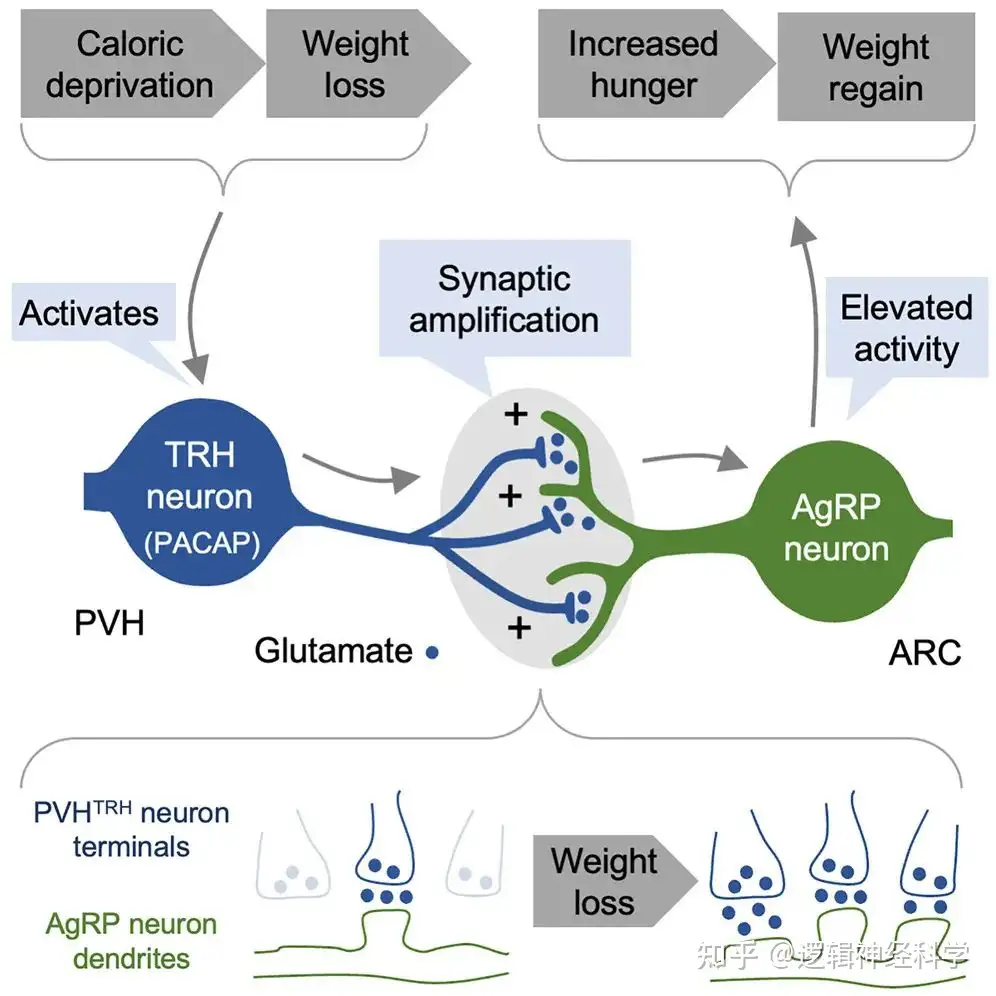
综上,本研究经过严谨的实验设计证明了饥饿使PVHTRH-AgRP的兴奋性突触传递增加,可长期影响进食行为和体重变(图8D)化。本研究进一步说明了研究与饥饿调节相关的明确下丘脑神经回路的重要性。在肥胖大流行的背景下,该研究结果从环路角度解释了节食后容易反弹的机制,为制定长期维持节食后减轻的体重的治疗策略提供了新的理论基础。本研究的不足之处在于所采用光遗传学-电生理学方法来研究PVHTRH-AgRP突触可塑性,可能受ChR2 的表达水平、光强度和切片中的记录位点的影响,因此很难确定PVHTRH-AgRP 观察到的le-qEPSC频率是由于树突棘的增加,需要组织免疫学进行验证。
原文链接:https://doi.org/10.1016/j.cmet.2023.03.002
转载须知:“逻辑神经科学”团队原创性内容,著作权归“逻辑神经科学”所有,欢迎个人转发分享,未经授权禁止转载,违者必究。

参考文献(上下滑动查看)
1. Berthoud, H.R. et al. (2021) Physiology of Energy Intake in the Weight-Reduced State. Obesity (Silver Spring) 29 Suppl 1, S25-S30. 10.1002/oby.23080
2. Vong, L. et al. (2011) Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron 71, 142-154. 10.1016/j.neuron.2011.05.0283. Pinto, S. et al. (2004) Rapid rewiring of arcuate nucleus feeding circuits by leptin. Science 304, 110-115. 10.1126/science.10894594. Krashes, M.J. et al. (2014) An excitatory paraventricular nucleus to AgRP neuron circuit that drives hunger. Nature 507, 238-242. 10.1038/nature12956
编辑︱王思珍
本文完