盛锡楠教授团队:肾癌治疗进展
近年来,免疫联合靶向药物用于晚期肾癌一线治疗的大型临床研究纷纷揭晓,2022年度ASCO肾癌治疗方面,仍然有许多重要进展,特别是围手术期,以及晚期阶段的序贯治疗结果,将会影响临床实践。
一、肾癌围手术期的治疗
肾癌围手术期治疗一直是临床研究的热点,2021年ASCO会议公布的KEYNOTE564研究证实了免疫治疗在高危肾癌术后辅助治疗取得成功,本次会议除了该项临床研究数据更新以外,还有依维莫司用于肾癌术后辅助治疗的Ⅲ期研究(EVEREST,SWOG S0931)结果的公布。
1.依维莫司未能改变靶向药物辅助治疗失败的命运
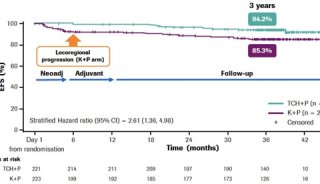
SWOG S0931研究是将依维莫司用于中高危肾癌术后辅助治疗的随机对照III期研究,主要研究终点为无复发生存期(RFS),这也是靶向时代最后一项靶向辅助治疗的大型临床研究。入组患者为中-高危(pT1 G3-4 N0-pT3a G1-2 N0)和极高危(pT3a G3-4 N0-pT4 G-any或N+),按1:1随机接受依维莫司(10 mg/每天,口服,54周)或安慰剂治疗。随机分组按照风险分组、组织学和ECOG评分进行分层。2011年4月至2016年9月总计入组1545例患者,其中极高危比例为55%;病理类型方面透明细胞癌为83%。最终结果显示依维莫司治疗组与安慰剂相比,依维莫司可以改善RFS(HR 0.85,95%CI 0.72-1.00;单侧P =0.025),5年RFS率的估计值分别为67%和63%,但未达到研究设计预定的单侧显著性水平0.022。总生存方面的数据尚未成熟,统计学方面未见显著差异。
很显然延续了既往靶向药物用于辅助治疗的临床研究结论,也就是说现有靶向药物无法改善肾癌术后无复发生存,但从这个亚组分析显示依维莫司可改善极高危组患者的RFS(未达到 vs 5.3年,HR 0.79,95%CI 0.65-0.97;单侧P=0.011),这又与其他靶向药物辅助治疗临床研究失败类似,入组人群过于宽泛,无论之前舒尼替尼的STRAC研究,还是免疫治疗KEYNOTE-564研究,都是聚焦于T3、T4或淋巴结转移这样的极高危人群取得成功。虽然免疫治疗对辅助治疗有独特的机制优势,但如果靶向药物与PD-1单抗对极高危人群都有获益,是否可以开展相应对照临床研究,毕竟口服药物更加便利。另外筛选分子特征,估计是未来辅助治疗临床研究人群筛选的一个重要趋势。
2.KEYNOTE 564研究的后续治疗分析进一步支持免疫辅助治疗价值
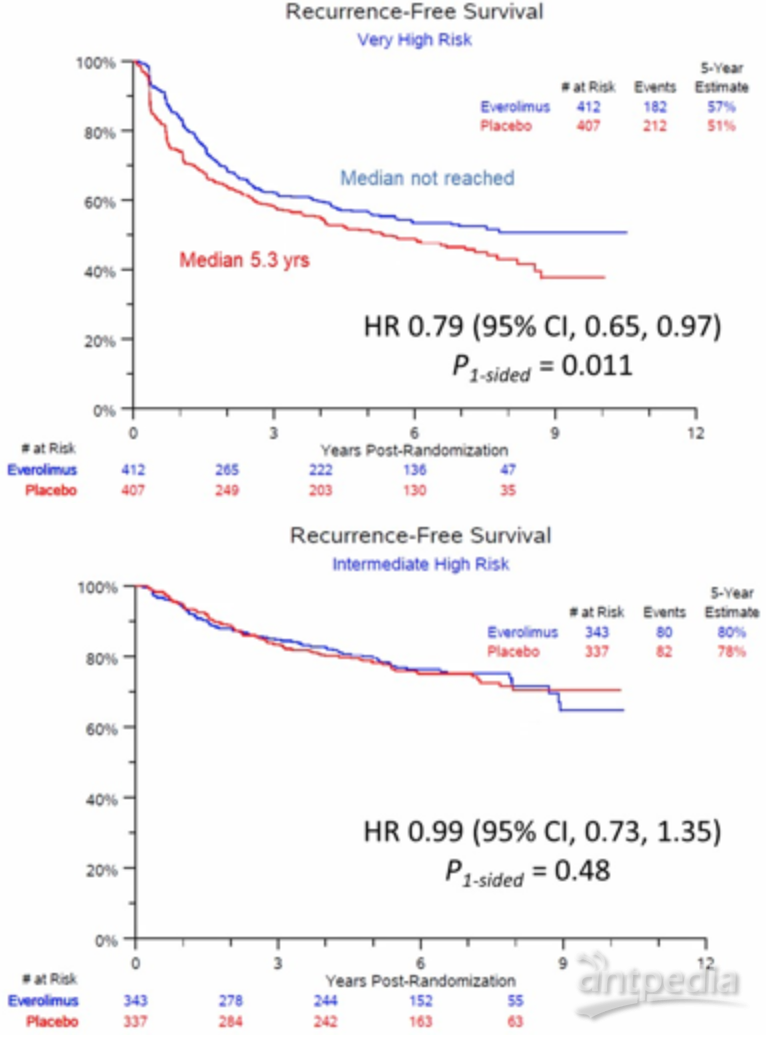
2022年ASCO-GU年会公布了KRYNOTE 564研究的30个月随访数据更新,结果显示相对于安慰剂,帕博利珠单抗辅助治疗的获益显著性进一步扩大,24个月的DFS率差值提高至11%(78.3% vs 67.3%)。本次ASCO会议在至第一次后续治疗或全因死亡时间(time to first subsequent drug treatment or any-cause death,TFST)和随机至下一线治疗失败或全因死亡时间(time from randomization to progression on next line of therapy or any-cause death,PFS2)上对30个月随访数据进行了进一步的疗效分析。
截止至2021年6月14日(中位30.1月,范围:20.8-47.5)。13.5%(67/496)的帕博利珠单抗组患者和19.9%(99/498) 的安慰剂组患者接受了≥1 线后续抗肿瘤药物治疗。而在帕博利珠单抗辅助治疗组的后续治疗中,接受VEGF/VEGFR靶向治疗和抗 PD-1/PD-L1单药药物的比例分别为95.5%和23.9%,安慰剂组为89.9%和60.6% 。
在帕博利珠单抗组和安慰剂组中分别观察到77 次和110次TFST 事件,与安慰剂相比,帕博利珠单抗辅助治疗显著延迟了TFST(HR,0.67;95% CI,0.50-0.90;未达到中位数)。在帕博利珠单抗组和安慰剂组中分别观察到40 例(8.1%;12 例死亡事件和 28 例进展)和 68 例(13.7%;14 例死亡事件和 54 例进展事件)PFS2 事件。与安慰剂相比,帕博利珠单抗也延迟了PFS2时间(HR,0.57;95% CI,0.39-0.85;未达到中位数)。这些分析结果表明帕博利珠单抗辅助治疗可以获得持续临床获益,支持RCC 高复发风险患者肾切除术后使用帕博利珠单抗作为标准治疗。
二、晚期肾透明细胞癌的治疗进展
近年来免疫联合靶向治疗开展了六项随机对照临床研究确立了免疫联合治疗用于晚期肾癌一线治疗地位,未来研究的重点更多侧重于免疫联合治疗失败后的二线治疗,后续的序贯治疗是否改变一线选择的疗效,以及新型药物成为今年ASCO的焦点。
1.晚期肾癌一线治疗越来越支持选择免疫为基础的联合治疗
以CLEAR研究为代表的免疫联合靶向将晚期肾癌的客观缓解率提高到71%,中位无进展生存时间延长到23.9月,极大的改变了晚期肾癌的治疗格局。但是另一方面,靶免联合治疗用于后线治疗也可以获得55.8%的客观有效率和12.2月的中位PFS(KEYNOTE 146),靶免联合治疗的序贯顺序也是目前临床关注的热点。本次ASCO大会报道了多项研究后续治疗对前线靶免联合治疗的影响,在这个问题上对我们有一定的启示意义。在研究方法上,多项探索性研究都纳入了PFS2作为研究终点,其定义为随机分组后接受初始治疗至后续治疗后疾病进展或死亡的时间。
(1)KEYNOTE-426研究后续治疗数据分析
2021年ASCO大会报道了KEYNOTE-426研究随访42月的结果,与舒尼替尼相比,帕博利珠单抗联合阿昔替尼死亡风险降低27%(HR 0.73,95% CI 0.60-0.88,P<0.001),中位OS延长了5.6月(45.7月vs 40.1月)。本次ASCO大会报道了后线治疗的数据。截止至2021年1月11日,中位随访时间为42.8个月(范围,35.6-50.6个月)。帕博利珠单抗+阿昔替尼组47.2%(204/432)的患者和舒尼替尼组65.5%(281/429)的患者接受后续治疗。帕博利珠单抗+阿昔替尼组后续治疗中抗PD-1/PD-L1抗体和VEGF/VEGFR抑制剂的比例分别为11.3%(23/204)和82.8%(169/204),索坦组的比例分别为54.8%(154/281)和43.4%(122/281)。
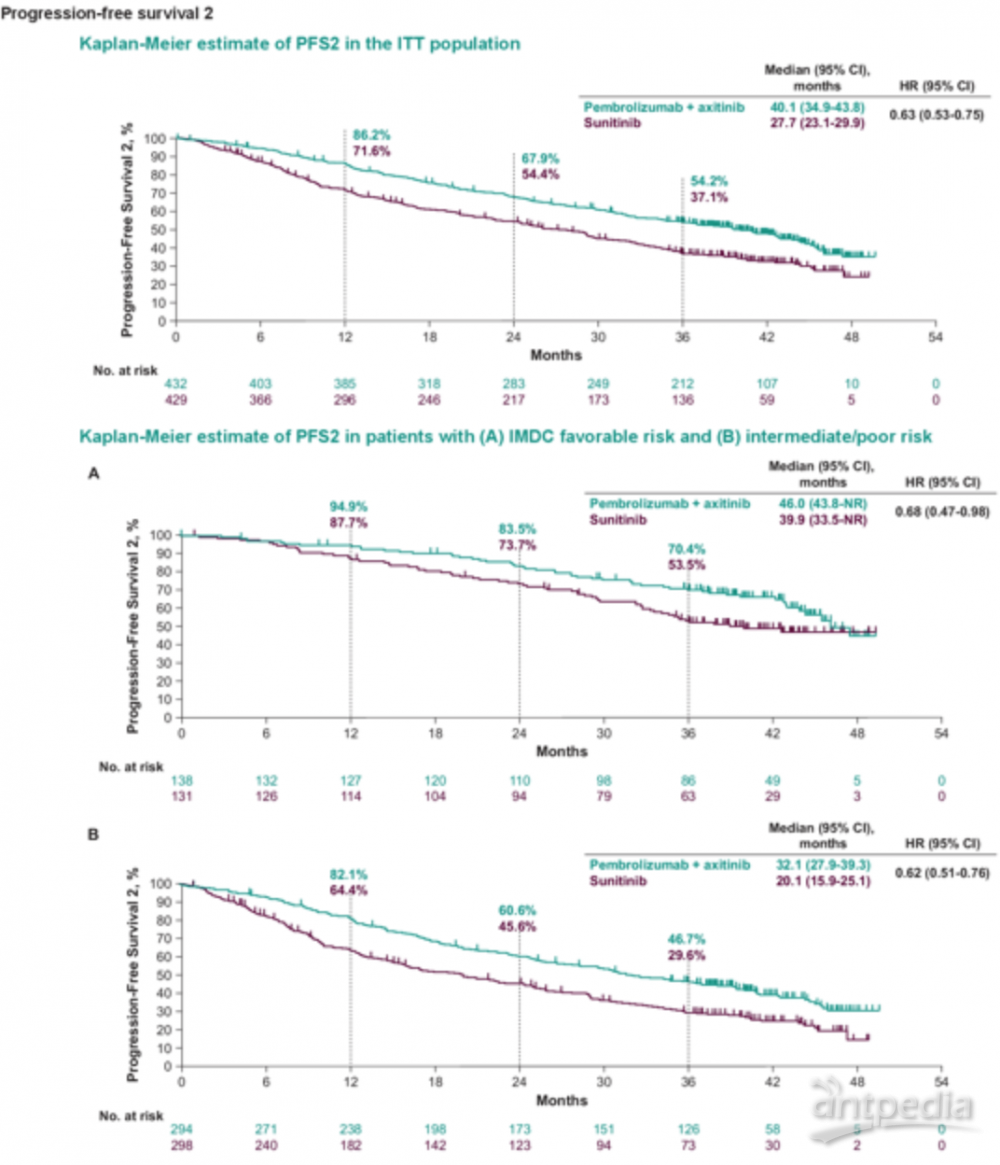
帕博利珠单抗联合阿昔替尼组和舒尼替尼组在ITT人群中的PFS2分别为40.1月和27.7月,其中在IMDC不同危险人群中,低危人群中分别为46.0和39.9月,中高危人群中分别为32.1和20.1月。研究结果显示,与舒尼替尼相比,帕博利珠单抗+阿昔替尼一线治疗的患者PFS2更长,在不同IMDC风险组中趋势一致。这一研究支持帕博利珠单抗联合阿昔替尼作为晚期肾透明细胞癌的一线治疗。
(2)CLEAR研究后续治疗数据分析
2021年ASCO GU公布的CLEAR研究在本次ASCO大会上也公布了后续治疗的数据。仑伐替尼联合帕博利珠单抗组和索坦组分别有33%(117/355)和57.7%(206/357)的患者接受了后续治疗。两组患者接受后续抗VEGF治疗的比例分别为30.4%和33.6%,接受PD-1/PD-L1抑制剂的比例分别为8.2%和43.1%。
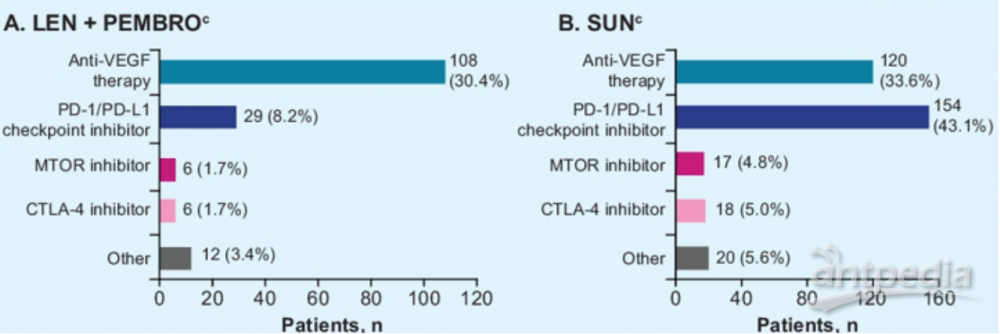
在所有患者中,仑伐替尼联合帕博利珠单抗组的PFS2比SUN组更长(中位数:未达到 vs 28.7月,HR 0.50;95% CI 0.39–0.65;P<0.0001),24月PFS2率分别为72.7%和54.2%,36月PFS2率分别为61.9%和42.9%。2021年报道的未经调整二线治疗影响的OS获益风险比为0.66(95% CI 0.49–0.88),本次大会报道的调整后续治疗影响的OS获益风险比为 0.54(95% CI 0.39-0.72)。
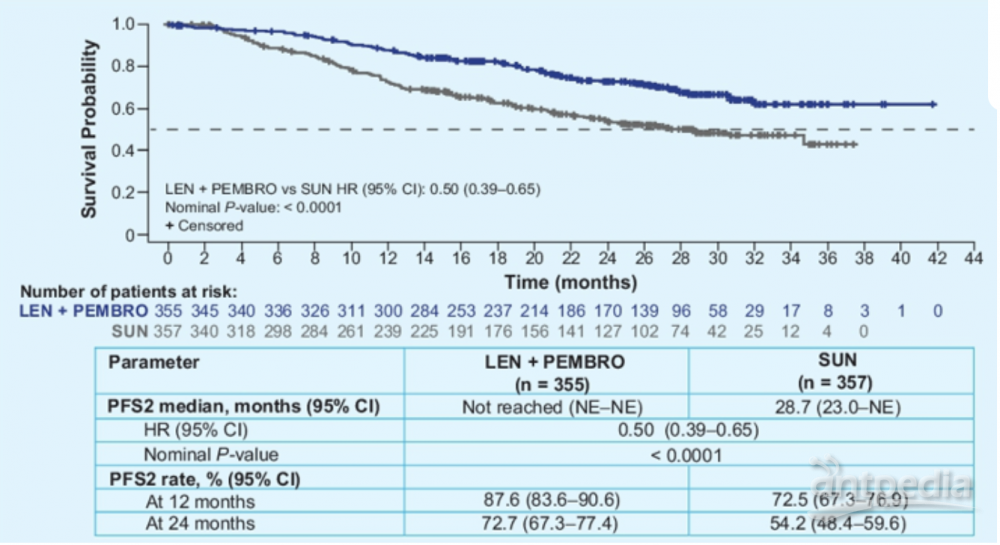
这些结论表明仑伐替尼联合帕博利珠单抗比索坦具有统计学意义和临床意义的生存获益。在调整了后续治疗的影响后,获益仍然保持一致,表现为PFS2延长和调整后的OS获益。这些结果进一步支持仑伐替尼联合帕博利珠单抗作为晚期肾细胞癌的一线治疗。
(3)纪念斯隆凯特琳癌症中心治疗数据分析
纪念斯隆凯特琳癌症中心在本次大会上报道了该中心于2014年1月1日至2020年12月30日接受靶免联合治疗(TKI/IO)和联合免疫治疗(IOIO)之间PFS2的差异。一线TKI/IO方案共83人,包括:阿昔替尼/帕博利珠单抗 34%,仑伐替尼/帕博利珠单抗 29%,阿昔替尼/阿维鲁单抗25%,其他11%,40名患者发生了PFS-2事件。一线IO/IO方案90人,有52人发生了PFS-2事件。IO/IO 组有更高比例的脑转移和中/低 MSKCC 风险患者(分别为p=0.007,p<0.001)。在一线治疗中,与IO/IO相比,TKI/IO组具有更高的 ORR和更长的治疗时间(65% vs 39%,p<0.001;16.1 vs 5.1月,p<0.001)。在二线治疗中,则是IO/IO 组ORR更高(47% vs 13%, P<0.001),中位治疗时间没有显着差异(7.7 vs 7.1,p =0.30)。
TKI/IO组的中位 PFS-2为44个月 (95% CI: 27, 53) ,IO/IO组为23个月 (95% CI: 16, 47,p=0.13)。TKI/IO和IO/IO组的12个月时的PFS-2率分别为86%和74%,36个月时的PFS-2率分别为 51%和42%。OS没有显着差异(p=0.32;3年OS:IO/IO 60%,95% CI 47-71%; TKI/IO 62%, 95% CI 49-73%)。
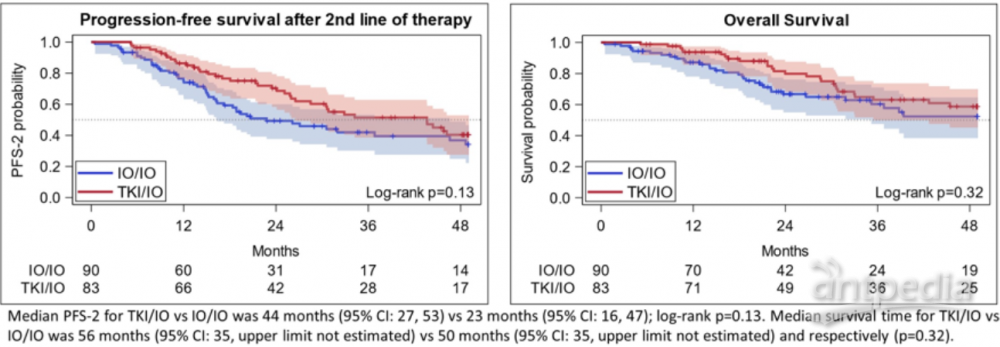
研究认为,在接受一线IO/IO或TKI/IO治疗的患者,IO/IO组二线ORR更高,TKI/IO组一线ORR更高,中位PFS-2在数值上更高,但在PFS-2或OS方面未观察到统计学上的显着差异。这些结果表明IO/IO和TKI/O都是ccRCC可接受的一线治疗策略。
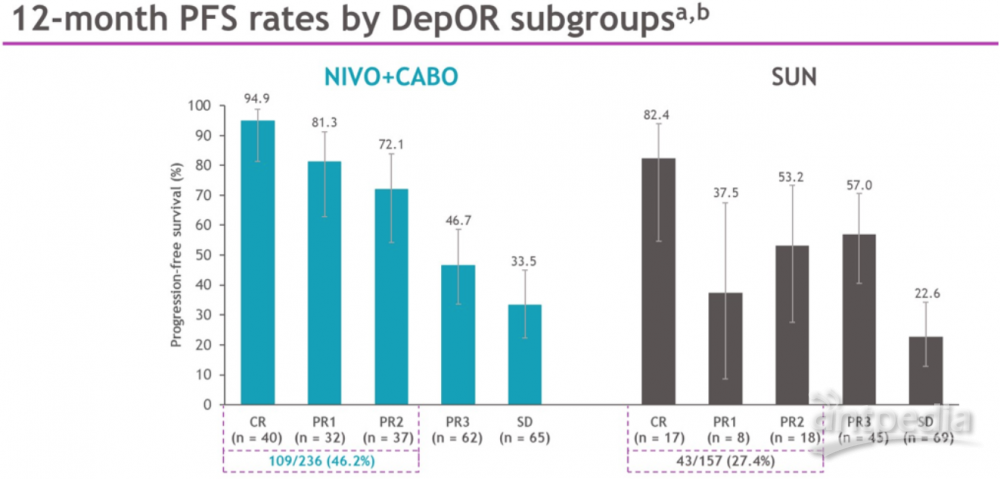
(4)CheckMate 9ER研究-缓解深度(DepOR)与预后
2022年ASCO GU报道了CheckMate 9ER研究中位随访时间32.9个月的数据,与舒尼替尼组相比,纳武利尤单抗联合卡博替尼治疗晚期RCC初治患者,无进展生存期(PFS,HR为0.56)和总生存期(OS,HR为0.70)显著延长。本次ASCO大会报了缓解深度(DepOR)与患者临床预后的关联性。研究将DepOR亚组基于最佳疗效(依据RECIST v1.1)和最佳肿瘤缩小阈值进行区分:完全缓解(CR);肿瘤缩小≥80%-<100%(PR1);≥60%-<80%(PR2);≥30%-<60%(PR3);疾病稳定(SD);疾病进展(PD)。随机化疗6个月后,对DepOR亚组的PFS和OS结果进行分析。总体而言,与舒尼替尼组相比,纳武利尤单抗联合卡博替尼组缓解程度更深(CR+PR1+PR2:38% vs 17%)。
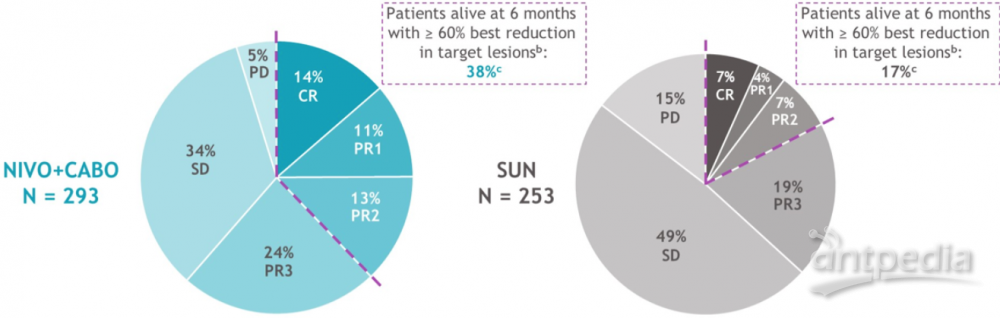
纳武单抗联合卡博替尼组更深的缓解程度与12个月的PFS率更高有关,CR(94.9% vs 82.4%)、PR1(81.3% vs 37.5%)、PR2(72.1% vs 53.2%)。
所有亚组中,缓解程度越深,OS结果更好。纳武单抗联合卡博替尼组获得CR、PR1和PR2的患者,18月OS率分别为97.5%,97%和83.5%,而索坦组分别为100%、100%和88.2%。
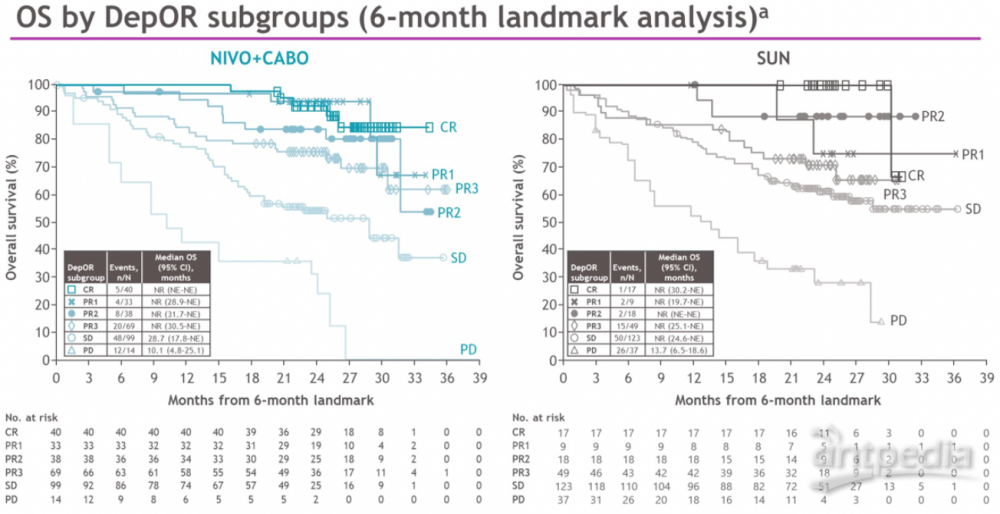
总生存期(OS)被认为是肿瘤临床试验的最终终点。但是,OS 数据成熟的时间可能会很长、成本很高,并且会延迟有效的治疗。无进展生存期 (PFS) 出现在OS之前,但由于癌症治疗过程中的后续治疗线,PFS通常与OS无关。后续治疗的影响可能会掩盖一线治疗的影响,因此尽管PFS显着改善,但临床研究中并不总是观察到OS益处。此外,有时一线疗法的PFS较短,但通过使肿瘤细胞对二线药物敏感来延长OS。另一种情况是,前线治疗结果可能会对序列中下一线治疗产生影响。因此,PFS2 可能比PFS1更准确地衡量治疗益处。为了解决这些问题,欧洲药品管理局 (EMA) 鼓励PFS2来评估两种治疗线的益处。一项纳入了15 项试验3368 名患者的荟萃分析也证实了PFS2和OS在跨多种肿瘤类型的实体瘤肿瘤(包含肾癌)的高度相关性。本次大会1项免疫辅助治疗、3项一线靶免联合治疗研究均显示PFS2延长和调整后线治疗因素影响后的OS获益,以及CheckMate 9ER研究缓解深度与预后的关系,均提示了早期积极治疗、或者说早期识别出治疗有效患者的重要性。专家讨论环节提到的PDIGREE研究(根据疗效选择治疗方案)和各种评效工具的选择,可能会为我们以后的临床工作提供参考意义。
2.晚期肾透明细胞癌的后续治疗新药进展
(1)CALYPSO研究
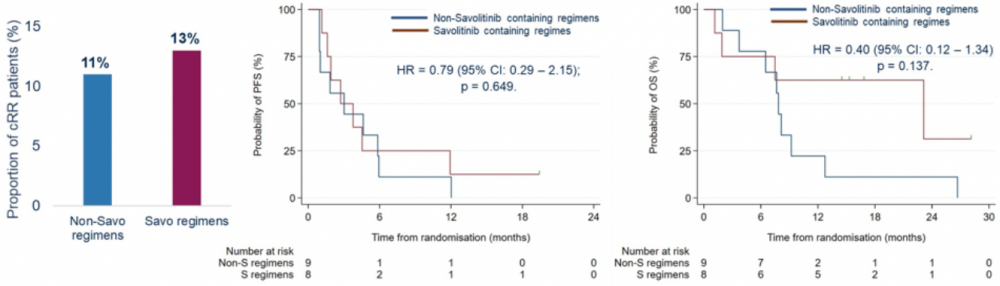
CALYPSO研究是一项国际、多中心、开放标签 II期研究,入组VEGF-TKI治疗失败的转移性肾细胞癌患者,接受度伐利尤单抗单药,或联合tremelimumab,或联合沃利替尼,或沃利替尼单药治疗。4组患者的ORR分别为10%,28%,13%和5%,均未达到预设的值得进一步探索的主要终点(ORR=50%)。度伐利尤单抗联合tremelimumab相对于度伐利尤单抗单药,PFS和OS并未得到显著延长,HR值分别为0.80(95%CI 0.48-1.33,P=0.382)和0.90(95%CI 0.49-1.65,P=0.729)。度伐利尤单抗联合沃利替尼相对于度伐利尤单抗单药,PFS和OS也未得到显著延长,HR值分别为1.21(95%CI 0.74-1.99,P=0.455)和1.62(95%CI 0.90-2.95,P=0.110)。在17例MET驱动的患者中,含沃利替尼方案相对于不含沃利替尼方案也没有取得PFS和OS获益,两者的ORR分别为13%和11%。尽管在MET驱动的转移性乳头状肾细胞癌中,度伐利尤单抗联合沃利替尼取得了53%的客观缓解率,在ccRCC中该联合方案则未取得预测的目标。MET激活可能并不是ccRCC的主要驱动通路。
(2)GAS6-AXL信号通路抑制剂
AXL 在VHL 缺陷肿瘤和缺氧肿瘤细胞中被缺氧诱导因子 1 信号上调,在转移性ccRCC的发展中可能具有更重要的作用。巴替拉西普(batiraxcept,AVB-500)是一种新型GAS6-AXL信号通路抑制剂,是一种重组融合蛋白,含有人AXL的胞外区,与人免疫球蛋白 G1 重链 (Fc) 结合,表现出高效、特异性AXL抑制。
本次ASCO大会公布了batiraxcept在治疗肾透明细胞癌(ccRCC)的1b/2期临床试验中的1b期的数据。研究采用3+3 剂量递增研究设计进行评估Batiraxcept(15 和 20 mg/kg)联合卡博替尼60 mg治疗的安全性、推荐的第2阶段剂量 (RP2D)、总反应率 (ORR) 和反应持续时间 (DOR)、血清可溶性AXL (sAXL)/GAS6与的 ORR 的相关性。
研究入组了26例未使用过卡博替尼的非初治ccRCC患者,15 mg/kg 组16人,20 mg/kg组10人。中位年龄60岁(40-81),男性 22人 (85%),中位既往治疗线1 (1-5),IMDC风险组低危者6人(23%);所有的患者既往均接受过免疫治疗,其中15人 (58%)既往接受过VEGF靶向治疗。截至2022年4月30日,92%的患者仍在接受治疗。在15 mg/kg 或20 mg/kg 剂量组未观察到剂量限制性毒性。22名受试者 (85%) 发生了不良事件(AE)。最常见的AE包括食欲下降31% (n=8)、腹泻和疲劳23%(n=6)。4名患者(15%) 发生3级AE,包括腹泻、血栓栓塞、高血压、小肠梗阻和血小板减少症(n=1,各 4%)。未观察到4级或5级相关AE。
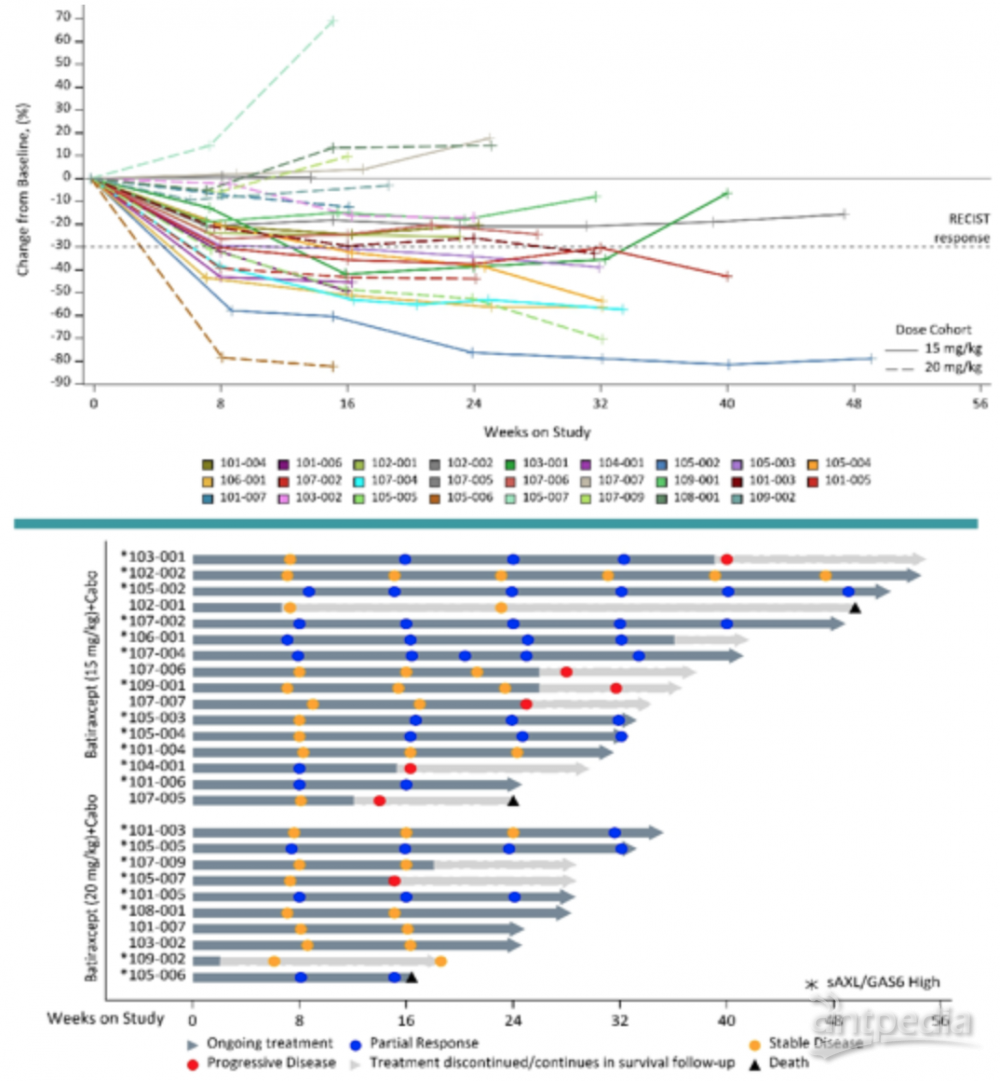
在疗效评估方面,88%(23/26)的患者肿瘤在8周评效时有缩小。所有人群的ORR为 46%(n=12,均为部分缓解),15 mg/kg剂量组最佳ORR为56%(9/16);20 mg/kg剂量组最佳ORR为30%(3/10),在基线sAXL/GAS6比值≥2.3的患者中,ORR为67%(12/18)。仅3例患者评效PD。7个月无进展生存率为71%。尚未达到中位缓解持续时间(DOR)。两种剂量的 PK 水平相似, GAS6 水平在给药期间受到抑制。
本研究入组人群在一线治疗的ORR为23%,batiraxcept联合卡博替尼方案的ORR达到了46%,并且有88%的患者肿瘤缩小,也高于卡博替尼单药的历史数据(ORR 46% vs 17-27.8%,7月PFS率 71% vs 50-60%),体现出较高的临床应用前景,此外,基线 sAXL/GAS6 也可作为潜在生物标志物。目前正在进行II期研究中。
(3)缺氧诱导因子 2α抑制剂
本次大会报道了HIF-2α抑制剂belzutifan治疗晚期RCC I期研究LITESPARK-001研究超过3年随访时间的更新数据。目前仍有9人(16%)在接受治疗,停药的主要原因是疾病进展(n=34;62%)。22 名患者 (40%) 经历了3级TRAE。最常见的(≥10%) 3级TRAE 为贫血 (n= 13; 24%) 和缺氧 (n= 7; 13%)。没有发现4 级或5级TRAE。在中位随访>3年的情况下,ORR仍保持为 25%,其中1例由PR转化为确认的CR (2%) ,13例仍为PR (23%);DCR仍保持在80%。IMDC低危的13例患者ORR为31%(均为PR),中高危者为24%,DCR两者患者分别为92%和76%。在既往接受过 VEGF和免疫治疗的39 名患者,8人获得了缓解(ORR = 21%;1名CR;7名PR);DCR为74%。在未接受过先前的VEGF/免疫治疗的16例患者中,6人达到缓解(ORR = 38%;均为PR),DCR为94%。中位DOR未达到(范围,3.1+ 至 37.9+ 个月),截至数据截止日期, 57%(8/14) 的客观缓解者仍处于缓解状态。整个队列的中位PFS仍为14.5个月(95% CI,7.3-22.1),3年PFS率为34%。
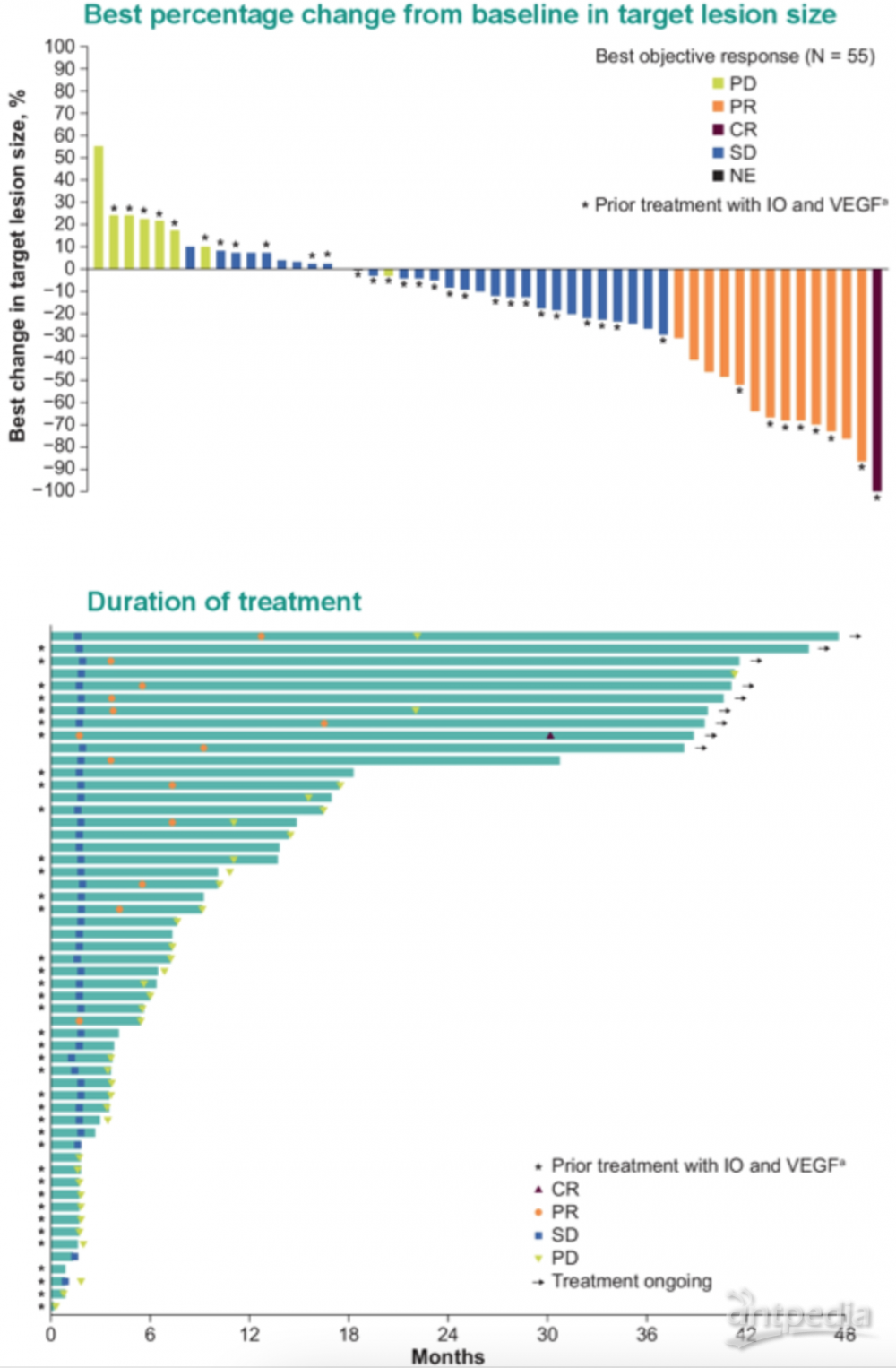
在中位随访41月的情况下,belzutifan单药在既往重度治疗的患者中继续显示良好的耐受性和持久的抗肿瘤作用(表现为持续的高疾病控制率和缓解持续时间),并且在不同的亚组中(IMDC分层、既往TKI或免疫治疗)均表现出抗肿瘤效果。目前正在探索的研究包括单药方案和联合方案、一线方案和辅助治疗方案等,国内北大肿瘤医院已经开展其与仑伐替尼联合的研究,以及前移在此基础上联合帕博利珠单抗的临床研究。
(4)核输出蛋白抑制剂
塞利尼索(selinexor,Xpovio)是一种首创、口服、选择性核输出抑制剂(SINE)化合物,通过结合并抑制核输出蛋白XPO1(又名CRM1)发挥作用,导致肿瘤抑制蛋白在细胞核内积累,这将重新启动并放大它们的肿瘤抑制功能,导致癌细胞选择性凋亡,同时不会对正常细胞造成显著影响。塞利尼索已被FDA批准2个肿瘤适应症,用于治疗五重难治性多发性骨髓瘤(MM)和复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)。
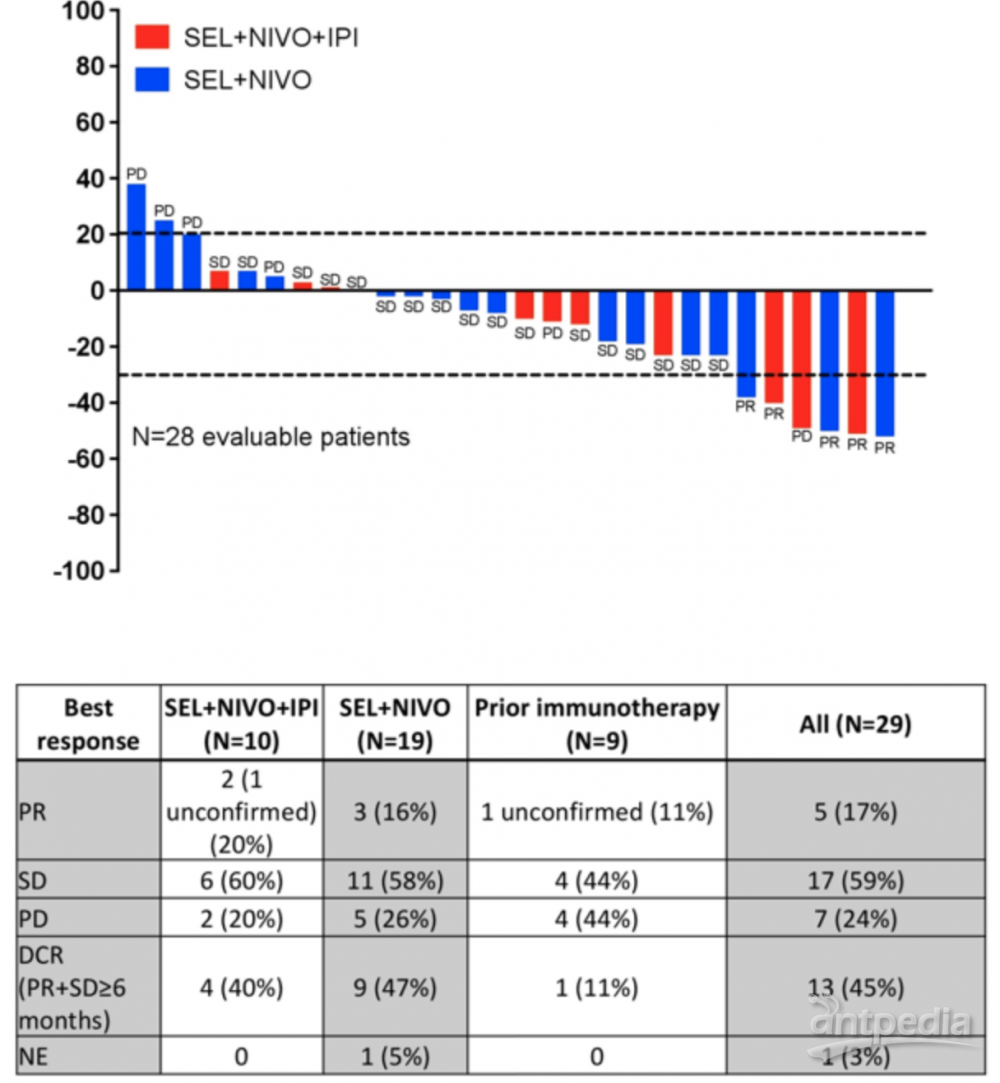
本次ASCO大会报道了塞利尼索联合免疫治疗IB期研究肾癌部分的初步数据。研究纳入了29名RCC患者(ccRCC 26名,72%为非初治患者),接受SEL+NIVO或SEL+NIVO+IPI治疗。SEL+NIVO组为:SEL 40mg biw (N = 8),或60mg biw (N = 11) ,NIVO 240mg Q2W 或480mg Q4W。SEL+NIVO+IPI组为:SEL 60 mg qw (N = 4) 或 80 mg (N = 6) qw,NIVO 3 mg/kgx 4个周期,然后 480 mg Q4W 加 IPI 1 mg/kg Q3W,共4个周期。
最常见的治疗相关≥3级不良事件(AE),包括内分泌失调(N = 3)、低钠血症 (N = 3)、白细胞减少症(N = 3)、转氨酶(N = 3)、血栓栓塞事件 (N = 2)、无症状脂肪酶升高(N = 2)、贫血(N =1)、肺炎(N = 1)、肾炎(N = 1)、结肠炎(N = 1)、疲劳(N = 1)。两例患者因AE停止治疗(SEL+NIVO+IPI引起的G3肺炎和SEL+NIVO引起的G3转氨酶升高)。
中位随访17.5月,5名患者 (17%) 获得了PR,17名患者(59%) 达到疾病稳定 (SD)。整个队列的中位PFS为17.5个月(SEL+NIVO+IPI:7.2个月,SEL+NIVO:17.5个月)。在透明细胞患者中接受 SEL+NIVO+IPI 作为一线 (1L) 治疗的4例患者均达到SD。中位总生存期(OS) 为 27.8个月(SEL+NIVO+IPI:未达到,SEL+NIVO:21.3个月)。在接受SEL+NIVO作为1L(N = 2) 的ccRCC患者中,一名患者获得了确认的PR,另一名患者获得了SD。结论:SEL与NIVO或NIVO+IPI联合治疗具有良好的耐受性,并表现出部分的的抗肿瘤活性。
(5)OX40 激动剂
免疫检查点阻断已经彻底改变了mRCC的治疗格局,但原发性和获得性耐药是临床需要解决的难题。共刺激OX40(CD-134) 可以激活耗尽的 T 细胞。在树突细胞中OX40 激活可以增加 T 细胞的增殖、效应功能和存活。PFOX是OX40的激动剂,PFOX+Axi相对于Axi单药,在免疫治疗失败的mRCC患者可能可以取得更好的效果。
摘要4529纳入59例免疫治疗失败的mRCC患者,随机接受Axi 5mg bid + PFOX 0.3 mg/kg q2w (N = 29) 或 Axi+安慰剂 (N = 30) 治疗组。主要终点是无进展生存期(PFS);次要终点包括总生存期(OS)、客观反应率 (ORR)、反应持续时间 (DOR) 和安全性/耐受性。预先指定的中期分析 (IA) 设定在PFS事件≥33,单侧P<0.02。中位随访13.4个月,联合治疗组中位PFS为10.2(6-15.8) 个月,单药组为8.5 (5.5-11) 月。HR值为0.85(95% CI: 0.45-1.60,p = 0.61)。根据MSKCC危险分层和既往治疗线数调整后,HR为0.74 (95% CI:0.38-1.46, p=0.39)。未达到中位 OS(调整后的HR = 0.71 [95% CI: 0.24-2.12] p=0.54)。2组患者的ORR分别为31%和40%,中位DOR 10.5 (3.2-29.4) 月和7.5 (1.8-32.7) 月。因此在免疫治疗失败的mRCC患者中,与单独使用Axi相比,Axi+PFOX 并未改善预后。
(6)钙粘蛋白6藕连ADC药物
钙粘蛋白6 (CDH6) 是钙粘蛋白家族的一部分,与细胞-细胞粘附、器官发育和上皮-间质转化相关。CDH6在各种癌症特别是肾癌和卵巢癌中过度表达。DS-6000a是一种抗体-药物偶联物,由人源化抗CDH6 IgG1单克隆抗体通过可切割的接头连接到拓扑异构酶 I (TOP1) 抑制剂组成。DS-6000a 特异性结合肿瘤细胞表面的CDH6并被内化绑定,然后释放有效载荷,导致靶细胞凋亡摘要3002报告了DS-6000a治疗晚期肾癌和卵巢癌I 期试验剂量递增(A 部分)的初步结果 (NCT04707248)。
起始剂量为1.6 mg/kg,然后是3.2、4.8、6.4、8 和 9.6 mg/kg,Q21d。截止至2021年11月19日,共入组22名患者(7名肾癌,15名卵巢癌)。所有肾癌患者均已接受免疫检查点抑制剂,大多数卵巢癌为铂类耐药 (Pt-R);中位年龄是63.5岁(范围,41-78);中位既往治疗线数为4 (范围, 1-12)。中位治疗时间为 8.0 周(范围 3-33.14)。在截止日期有15人(68.2%) 仍在进行中。17 名患者 (77.3%) 出现治疗中出现的不良事件 (TEAE)。在 15 个可评估的患者中,2 个患者获得PR(1 例肾癌为确认PR,1例卵巢癌为尚未确认的PR),9例患者获得SD。因此该研究剂量递增阶段的中期数据显示,在重度治疗的晚期肾癌和 Pt-R卵巢癌患者中,DS-6000a耐受性良好,并显示出初步的疗效,值得在剂量扩展试验中进行进一步验证。
三、晚期非透明细胞癌的治疗
近些年,针对晚期非透明细胞癌(nccRCC)的研究越来越多,但由于nccRCC病理类型众多,但发病率极低,绝大多数研究以回顾性分析为主,但这些研究对我们临床诊疗工作仍然有参考价值。
ORACLE研究回顾性的纳入了接受联合治疗(IO-IO、IO-VEGF或mTOR+VEGF)的128 例nccRCC 患者,主要终点是研究者审查评估的客观缓解率(ORR),次要终点是无进展生存期(PFS)、疾病控制率(DCR)和总生存期(OS)。患者中位年龄为57岁,66%为男性,65%为白人。组织学包括乳头状(37%)、未分类 (33%)、嫌色细胞(16%)、易位(9%) 和其他类型(5%)。69%的患者既往接受过肾切除术; 80%为IMDC中/低风险;20%伴有肉瘤样和/或横纹肌样瘤分化, 肝转移和骨转移的比列分别为27%和29%,63%的患者为一线治疗。IO-IO、IO-VEGF和mTOR+VEGF方案一线治疗的ORR分别为24%、28%和17%,后线治疗的ORR分别为5%、0%和10%,在乳头状肾细胞癌分别为8%、7%和0%,在嫌色细胞癌分别为20%、0%和33%。伴肉瘤样分化患者接受IO-IO或IO-VEGF方案的ORR较高,分别为39%和37%。IO/IO和IO/VEGF方案相对于VEGF/mTOR 方案具有更长的PFS和OS,分别为 8.5 vs 9.5 vs 3.7月和24.4 vs 18.2 vs 15.4月。虽然这些数据仍需要进一步前瞻性临床研究证实,但对于日常临床工作,有一定的参考价值。
-
项目成果