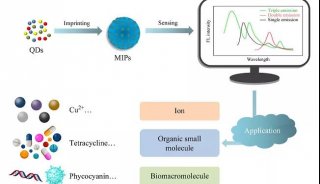
我国学者在有机硅点及药物递送方面取得重要进展
日前,东南大学生物科学与医学工程学院、生物电子学国家重点实验室吴富根教授和美国密歇根大学陈战教授合作,首次合成了荧光量子产率高达100%的绿色发光有机硅点(organosilica nanodots,OSiNDs),并以此实现了超长时间的溶酶体特异性荧光成像。相关成果以“One-Step Synthesis of Ultrasmall and Ultrabright Organosilica Nanodots with 100% Photoluminescence Quantum Yield: Long-Term Lysosome Imaging in Living, Fixed, and Permeabilized Cells”为题发表在Nano Letters(IF = 12.712,

该团队以廉价且商用化的硅烷试剂和孟加拉玫瑰红为原料,通过水热法一步合成了具有极佳水分散性、超高量子产率(~100%)、极窄荧光发射峰(半峰宽约30 nm)的绿色荧光有机硅点。同时,该硅点能实现对哺乳动物细胞溶酶体的长时间特异成像(长达48小时),并且其溶酶体成像效果不受细胞清洗、固定或透化等处理的影响。此外,该硅点还具有制备成本低、合成方法简单、光稳定性好、细胞相容性好和光毒性低等优点,是一种极具应用价值的潜在商用化试剂。现在应用最广泛的商用溶酶体探针LysoTracker系列染料的价格极为昂贵(3500-4500元/mL),且无法实现对固定或透化处理后的细胞的成像。目前,该超亮有机硅点材料已申请中国发明ZL(ZL申请号:2017104788652),相关转化及推广工作正在准备中。
在另一项工作中,该团队首次利用光调控细胞核膜通透性的策略构建了一种具有普适性的光响应纳米平台,可用于协助多种小分子及纳米颗粒的细胞核内递送。相关成果以“Development of a Light-Controlled Nanoplatform for Direct Nuclear Delivery of Molecular and Nanoscale Materials”为题在线发表在《美国化学会志》(即Journal of the American Chemical Society,影响因子13.858)上。

该工作利用多面体低聚倍半硅氧烷共价接枝聚乙二醇高分子和孟加拉玫瑰红,构建了一种自组装光响应纳米颗粒。该纳米材料具有酸性pH响应并且在光照条件下可以产生大量具有极强氧化能力的单线态氧,因此被溶酶体捕获后能够有效破坏溶酶体结构。在逃逸出溶酶体后,该纳米颗粒由于多氨基的存在展示出明显的细胞核膜定位,在光照下进一步破坏核膜来增强膜通透性。实验结果显示该材料不仅能够作为纳米载体装载小分子物质实现高效进核,还能够通过这种光触发破坏核膜的方法实现其他纳米颗粒(如金纳米棒和普鲁士蓝纳米颗粒)的进核。相比于传统的核定位多肽修饰来实现物质进核的策略,这种利用光调控物质进核的方法可控性强,进核效率高,打破了核孔对进核物质尺寸和形貌的限制,并且具有很好的普适性。
近几年来,该团队还在其他荧光硅点的制备及其生化检测应用方面作出了系列工作:合成了量子产率达80%的蓝色荧光硅点(Advanced Materials Interfaces 2015, 2, 1500360;Inside front cover),实现了对多巴胺(Analytical Chemistry, 2015, 87, 3360)和金属离子(Advanced Materials Interfaces 2015, 2, 1500360;Inside front cover)的检测,以及对革兰氏阴阳性细菌的区分以及抗菌应用等(Advanced Functional Materials, 2016, 26, 5958;Front cover)。同时,该团队还开展了一系列关于亚细胞器荧光探针和光调控方面的工作,包括基于细胞膜的荧光探针和光疗(J. Mater. Chem. B 2015, 3, 6165;J. Mater. Chem. B 2016, 4, 834;Bioconjugate Chem. 2016, 27, 782;ACS Biomater. Sci. Eng. 2016, 2, 987;Langmuir 2016, 32, 10126;ACS Appl. Mater. Interfaces 2017, 9, 15943;J. Control. Release 2017, 255, 231.),定位于线粒体的荧光探针和光疗(ACS Biomater. Sci. Eng. 2017, 3, 3596;Nanoscale 2017, 9, 18368;Nanoscale 2017, 9, 10948.)以及光热材料进核(ACS Appl. Mater. Interfaces 2018, 10, 1544.)等。
以上两篇论文东南大学均为第一完成单位。相关工作得到了国家自然科学基金、生物电子学国家重点实验室、江苏省优势学科、江苏省优秀青年基金、江苏省“双创人才”计划和江苏省“六大人才高峰”计划等经费的支持。
-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 5684
询底价 Tel:400-6699-117 转 5684 -
仪器推荐

-
仪器推荐

-
仪器推荐

-
科技前沿